Light DW, Lexchin JR. Pharmaceutical research and development: what do we get for all that money? BMJ. 2012 Aug 7;345:e4348. doi: 10.1136/bmj.e4348. http://bit.ly/NbZjk7
millón de gracias por tan valioso aporte!!!
hemos retocado un poco la traducción y agregamos los gráficos
Investigación y desarrollo de medicamentos: ¿qué obtenemos a cambio de todo ese dinero?
Donald W Light1, Joel R Lexchin2
Desde principios de la década de los 2000, los representantes de la industria farmacéutica, estudiosos y políticos han venido afirmando que existe una crisis de la innovación en la investigación farmacéutica. Una investigación publicada en primera página por el Wall Street Journal en el año 2002 comentaba “a lo largo del mundo, los científicos a la caza de nuevos medicamentos tienenuna escasez de ideas … la industria farmacéutica de los 400 mil millones de dólares anuales está, repentinamente, en serios problemas”1.
Cuatro años más tarde, la Oficina de Contabilidad del Gobierno de los EEUU realizó una evaluación del desarrollo de nuevos medicamentos, afirmando que “en los últimos años se ha reconocido ampliamente dentro del sector de la industria farmacéutica que la productividad de su inversión en investigación y desarrollo ha disminuido”2.
En 2010, Morgan Stanley informaba de que los altos ejecutivos de la industria sentían que no podían “derrotar la crisis de la innovación” y proponía que la mejor forma de lidiar con “una década de deprimentes retornos en I+D” era, para las grandes compañías, dejar de investigar nuevos medicamentos y comprar aquellos descubiertos por otros3. Dichos informes perpetúan e incrementan la idea de que la aparición de nuevos medicamentos pronto se agotará y quedaremos a merced de los males que nos sobrevengan4.
El mito de la “crisis de innovación”
La publicación constante de informes y artículos sobre la denominada "crisis de innovación" se basa en la disminución de nuevas entidades moleculares (definidas como “un ingrediente activo que no se ha comercializado previamente… bajo ninguna formulación farmacéutica” 5) desde un pico máximo en 1996, fruto de la autorización de solicitudes acumuladas luego de que se iniciara un nuevo plan de tarifas por la revisión de las solicitudes de comercialización (Fig 1).
Fig 1. La crisis de innovación que comenzó en 1997 supone una vuelta a la antigua media de nuevas aprobaciones después de un pico artificial producido por factores politicos
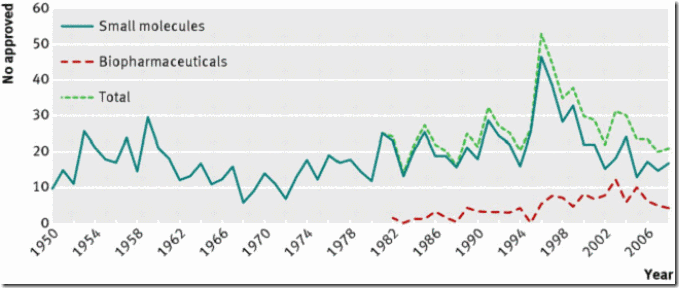
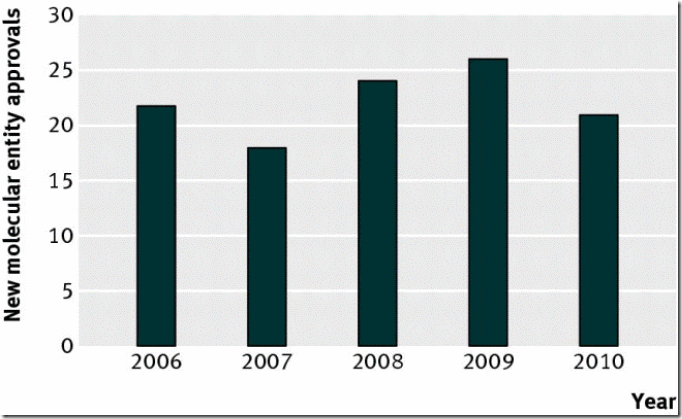
Este descenso terminó en 2006, cuando la aprobación de nuevas entidades moleculares volvió a su antiguo promedio de entre 15 y 25 por año (Fig 2)6. Incluso en 2005, un análisis de los datos por un equipo de Pfizer concluyó que la crisis de innovación era un mito “que no guarda relación con las verdaderas tasas de innovación de la industria farmacéutica” 7.
Fig 2. La tasa de aprobación de nuevas entidades moleculares volvió a su antigua media en el 2006
Entonces, ¿por qué no cesan estas afirmaciones e historias?
Un análisis posterior también concluyó que la crisis de innovación era un mito y a la vez añadía akgunas reflexiones al respecto. A partir de los registros de la FDA, Bernard Munos, un consultor de renombre vinculado a la innovación tecnológica, describió que las compañías farmacéuticas “han lanzado productos innovadores a un ritmo constante durante casi 60 años”. Los nuevos productos biológicos han seguido un patrón similar “en el cual las aprobaciones fluctúan en torno un nivel bajo y constante”8.
Estos datos no se corresponden con las quejas frecuentes acerca de las dificultades para obtener la aprobación de un nuevo medicamento. Asimismo opina que ni las políticas consideradas como obstáculos a la innovación (como el requerimiento de estudios clínicos más exhaustivos) ni aquellas que promocionan la innovación (como revisiones aceleradas) han supuesto una gran diferencia en la geeneración de innovación. Incluso la revolución biotecnológica no cambió el ritmo de aprobación de nuevas entidades moleculares, aunque cambió las estrategias para el desarrollo de fármacos” 9.
Mientras tanto, la estrategia de contar historias de “crisis de innovación” a los políticos y a la prensa sirve para atraer una mayor protección gubernamental contra el mercado libre y la competencia de los productos genéricos10-11.
La verdadera crisis de innovación
Más relevante que el número absoluto de nuevos medicamentos comercializados es el número de mediacamentos que representan un avance terapéutico. Aunque la industria farmacéutica y sus analistas miden la innovación en términos de nuevas entidades moleculares en lugar de nuevos medicamentos terapéuticamente superiores, la mayoría de estas nuevas entidades solo ha proporcionado mínimas ventajas clínicas en comparación con otros tratamientos existentes.
El predominio de los fármacos sin ventajas terapéuticas significativas nos retrotrae a a la “era dorada” de la innovación. De 218 fármacos aprobados por la FDA entre 1978 y 1989, solo 34 (15,6%) se consideraron como avances terapéuticos importantes 12.
Durante un periodo de tiempo bastante similar (1974-1994), el informe Barral de la industria sobre todos los nuevos fármacos comercializados internacionalmente, concluyó que solo el 11% de los fármacos supusieron una innovación terapéutica y farmacológica13.
Desde mediados de los 90, revisiones independientes también arribaron a la conclusión de que aproximadamente el 85-90% de todos los nuevos medicamentos aportaron poco o ningún beneficio terapéutico para los pacientes 14-19.
Este aumento leve y constante de medicamentos superiores clínicamente contrasta con el estado de revisión “prioritario”, concedido por la FDA al 44% de todos los nuevos fármacos desde 2000 a 2010 20. El porcentaje de medicamentos con la designación de prioritarios comenzó a aumentar en 1992 cuando las compañías comenzaron a financiar el proceso de aprobación de los fármacos de la FDA . Otras agencias reguladoras han clasifacado a pocos de esos medicamentos como candidatos para una revisión prioritaria 21. Las evaluaciones post-comercialización durante el mismo periodo son mucho menos generosas a la hora de asignar avances terapéuticos significativas a los nuevos fármacos 18-21.
Esta es la verdadera crisis de innovación: la I+D farmacéutica produce en la mayoría de los casos variaciones menores de fármacos ya existentes, y la mayoría de los nuevos fármacos no tienen impacto superior a medicamentos más antiguos en las mediciones clínicas.
Aunque un flujo constante de nuevos medicamentos con valor terapéutico añadido ha contribuido a aumentar el arsenal terapéutico del que se benefician millones de personas, los medicamentos también han producido una epidemia de reacciones adversas graves que deben añadirse a los costos nacionales de salud 22.
¿Cuánto cuesta el I+D?
Aunque la industria farmacéutica reslata constantemente las elevadas sumas de dinero que destina al descubrimiento de nuevos medicamentos, muy poco de ese dinero va a parar realmente a la investigación básica.
Los datos provenientes de informes de las propias compañías, de la Fundación Nacional de Ciencias de los Estados Unidos, y del gobierno indican que las compañías solo gastan el 1,3% de los ingresos en investigación básica para el descubrimiento de nuevas moléculas, una vez se descuentan los subsidios procedentes de los contribuyentes 23.
Más del 80 % del total de fondos destinados a la investigación básica para el descubrimiento de nuevos medicamentos y vacunas proceden de fuentes públicas 24.
Además, a pesar de las frecuentes reivindicaciones de la industria de que el costo del descubrimiento de nuevos fármacos suponen ahora un gasto de US$1.300 millones 25 esta cifra, procedente de la industria según el Centro Tufts en Boston 26, ha recibido muchas críticas.
La mitad del total procede de la estimación de los beneficios obtenidos si se invirtiera el dinero en un fondo indexado de compañías farmacéuticas con un aumento del valor del 11% anual acumulado, durante 15 años 26.
Aunque los comités financieros lo utilicen para estimar si merece la pena invertir en una nueva operación, estos supuestos beneficios (bastante mayores que el aumento del valor de las acciones de la industria farmacéutica) no deberían contabilizarse como costos en I+D en los que los beneficios están por llegar.
Los contribuyentes pagan la mitad de los US$ 650 millones restantes a través de deducciones y créditos a las compañías, lo que reduce la estimación a una cuarta parte de los US$ 1.300 millones o US$ 330 millones de dólares 27. Los autores del estudio del centro Tufts indican que su estimación se realizó sobre la quinta parte de los fármacos nuevos más costosos (aquellos desarrollados por la industria), los cuales, según los autores, fueron 3,44 veces más costosos que la media, lo cual redujo la estimación a US$90 millones. La mediana de los costos fue un tercio inferior a la media, es decir, US$60 millones. La deconstrucción de otros factores que aumentan esta cifra disminuiría aún más la estimación de los costos.
Modelo de negocio oculto
¿Cómo hemos llegado a una situación en la que parece que se gasta mucho dinero en I+D, aunque solo 1 de cada 10 medicamentos aprobados recientemente aporta un beneficio sustancial a los pacientes? La baja exigencia de ser mejor que el placebo, utilizando criterios de valoración secundarios en lugar de resultados clínicos claros, o criterios de no inferioridad con respecto al comparador, permite la aprobación de medicamentos que incluso pueden ser menos efectivos o menos seguros que los fármacos existentes. Ejemplos notables son rofecoxib (Vioxx), rosiglitazona (Avandia), gatifloxacino (Tequin), y drotrecogina alfa (Xigris).
Aunque la vasta red de departamentos de relaciones públicas y asociaciones comerciales de la industria generan un gran volumen de historias sobre la renombrada crisis de innovación, el papel clave de los fármacos superventas, y la crisis creada por “el abismo de la patente” 28 el modelo de negocio oculto de las farmacéuticas se centra en producir variaciones menores, algunas de las cuales se convierten en superventas.
En una serie de artículos escritos por Kalman Applbaum se describe cómo las compañías usan “la gestión de los ensayos clínicos, la publicación de investigaciones, el cabildeo a los reguladores, la formación a médicos y pacientes, el precio de los fármacos, la publicidad, y la promoción dirigida al consumidor” para crear distintos perfiles de márketing y la lealtad a la marca comercial para productos terapéuticamente similares 29.
Las ventas de estos fármacos generan beneficios constantes durante la vida comercial de los superventas hasta la finalización de la patente. Por ejemplo, aunque Pfizer perdió la exclusividad de mercado para atorvastatina, venlafaxina, y otros superventas en 2011, sus ingresos permanecieron constantes en comparación con 2010 y el ingreso neto aumentó un 21% 30.
Applbaum argumenta que el márketing se ha convertido en “el enemigo de la [auténtica] innovación” 31. Esta perspectiva explica por qué las compañías piensan que resulta útil pagar no solo por el estudio de los nuevos fármacos sino también por los cientos de ensayos de fármacos ya existentes con el fin de obtener la aprobación para nuevas indicaciones y expandir así el mercado 32.
Esta estrategia corporativa funciona porque los departamentos de márketing y las grandes redes de clínicos líderes de opinión patrocinados por la industria logran persuadir a los médicos para que prescriban los nuevos productos 33.
Un análisis de los gastos farmacéuticos en Canadá halló que el 80% del incremento de su
presupuesto destinado a fármacos se gasta en nuevos medicamentos que ofrecen muy pocos beneficios adicionales 16.
Entre los mayores contribuidores a este aumento se incluyen nuevos fármacos antihipertensivos, gastrointestinales y anticolesterolemiantes, incluyendo atorvastatina, la quinta estatina en el mercado canadiense.
El mito de un I+D insostenible
Para complementar la sucesión de artículos sobre la crisis de innovación nos encontramos con los artículos que tratan los costos de I+D como “insostenibles” para el reducido número de nuevos medicamentos aprobados. Estas afirmaciones sirven para justificar un mayor respaldo y protección gubernamental contra la competición de los genéricos, fortaleciendo medidas como una mayor exclusividad de datos y más subsidios públicos. Sin embargo, aunque los costos de I+D notificados aumentaron sustancialmente entre 1995 y 2010 en US$ 34.200 millones, los ingresos procedentes de los entes públicos aumentaron seis veces más rápido, en US$ 200.400 millones 25. Las compañías exageran los costos del desarrollo al centrar su discurso en el aumento autodeclarado de los costes y no mencionar los extraordinarios ingresos procedentes de los contribuyentes. Invariablemente, los beneficios netos, tras impuestos, siguen siendo sustancialmente superiores que los beneficios del resto de compañías pertenecientes a la lista del Fortune 500 34.
Este modelo de negocio oculto para la investigación, las ventas y los beneficios de las compañías farmacéuticas lleva tiempo dependiendo menos de la investigación revolucionaria que tanto enfatizan los ejecutivos, y más en las acciones de actores racionales que explotan patentes más amplias y duraderas y otras protecciones gubernamentales contra la competencia habitual del libre mercado. Las compañías están encantadas cuando se descubren fármacos revolucionarios, pero no dependen de estos, a pesar de que declaren lo contrario. Si comparamos el 1,3% de los ingresos dedicados al descubrimiento de nuevas moléculas 23 con el 25%, según estimaciones de un análisis independiente, de gasto en promoción 35, obtenemos un índice de investigación básica versus márketing de 1:19.
Hacia medicamentos más costo-efectivos y más seguros
¿Qué podemos hacer para cambiar el modelo de negocio de la industria farmacéutica y centrarnos en medicamentos más costo-efectivos y más seguros?
El primer paso debería ser detener la aprobación de tantos fármacos nuevos con escaso valor terapéutico.
La Agencia Europea del Medicamento (EMA) hace a Europa un flaco servicio al aprobar el 74% de todas las nuevas solicitudes a partir de ensayos diseñados por las compañías, mientras que mantienen en secreto los datos sobre la eficacia y la seguridad 36-37. El 29% de los nuevos productos biológicos aprobados por la EMA recibieron advertencias de seguridad en sus primeros diez años de comercialización 38, y los fármacos terapéuticamente similares por definición no ofrecen ventajas que compensen el riesgo desconocido de producir un daño mayor.
Necesitamos reactivar la cláusula noruega “necesidad médica” que limitaba la aprobación de nuevos fármacos a aquellos que ofrecían una ventaja terapéutica sobre productos existentes 39.
Este enfoque llevó a Noruega a tener siete anti-inflamatorios no esteroideos en el mercado en comparación con los 22 de Países Bajos 40.
La cláusula noruega “necesidad médica” se eliminó en 1996, cuando se armonizó su proceso de aprobación de fármacos con respecto al resto de la UE. Los países de la UE pagan miles de millones más de lo necesario por fármacos que proporcionan un beneficio sanitario escaso porque los precios no están establecidos para recompensar los nuevos fármacos en proporción al valor clínico que añaden.
Asimismo la financiación de la EMA y de otras agencias reguladoras debería proceder por entero de fondos públicos, en lugar de basarse en las cuotas que paga la industria, para terminar con el poder que la industria tiene sobre su regulador. Finalmente, consideramos nuevas formas de recompensar directamente a la innovación, como los grandes premios en metálico previstos en el Proyecto de Ley 137 del Senado, en lugar de precios elevados generados por la protección de la patente 41.
El proyecto de ley propone la recaudación de varios miles de millones de dólares anuales procedentes de 11 programas federales y no federales de reembolso y seguro sanitario, y un comité concedería los premios en función de cómo los nuevos fármacos responden a necesidades clínicas no cubiertas y si constituyen una ventaja terapéutica verdadera. Sin estar protegidos por patentes, los nuevos fármacos estarían abiertos inmediatamente a la competición de los genéricos, por lo que se reducirían los precios, mientras que al mismo tiempo los innovadores serían recompensados rápidamente para que sigan innovando. Con este enfoque los países ahorrarían miles de millones en el gasto en medicamentos y la salud de las personas se vería beneficiada.
La verdadera crisis en la investigación farmacéutica
El número de licencias de nuevos fármacos permanece en la antigua media de 15-25 anuales.
Sin embargo, el 85-90% de los nuevos productos en los últimos 50 años han proporcionado pocos beneficios y considerables daños.
La industria farmacéutica dedica la mayoría de los fondos para la investigación al desarrollo de nuevas variaciones menores que producen un flujo estable de beneficios.
Las fuertes promociones de estos fármacos contribuyen al sobreuso y suponen el 80% del incremento del gasto farmacéutico de una nación. Unas estimaciones infladas de los costos medios del I+D se emplean para cabildear y obtener mayor protección contra la competencia del mercado libre.
|
Autores
DWL concibió, investigó, y escribió el manuscrito inicial. JRL investigó y efectuó la revisión, realizando cambios sustanciales.
Referencias
1. Harris G. For drug makers, good times yield to a new profit crunch. Wall Street Journal 2002 Apr 18.
2. United States Government Accounting Office. New drug development. GAO, 2006.
3. Morgan Stanley. Pharmaceuticals: exit research and create value. Morgan Stanley, 2010.
4. Wilson D. Drug firms face billions in losses in ’11 as patents end. New York Times 2011 Mar 6. www.nytimes.com/2011/03/07/business/07drug.html?_r=1&pagewanted=all.
5. US Food and Drug Administration. Drugs@FDA glossary of terms. 2012. http://www.fda.gov/ Drugs/InformationOnDrugs/ucm079436.htm?utm_campaign=Google2&utm_source=fdaSearch&utm_medium=website&utm_term=“glossary%20of%20terms”&utm_content=2.
6. US Food and Drug Administration. New molecular entity approvals for 2010. Silver Spring: FDA, 2011. www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicApprovalReports/UCM242695.pdf.
7. Schmid E, Smith D. Is declining innovation in the pharmaceutical industry a myth? Drug Discov Today 2005;10:1031-9.
8. Munos B. Lessons from 60 years of pharmaceutical innovation. Nature Rev Drug Discov 2009;8:959-68.
9. Hopkins MM, Martin PA, Nightingale P, Kraft A, Mahdi S. The myth of the biotech revolution: an assessment of technological, clinical, and organizational change. Res Policy2007;36:566-89.
10. Adamini S, Maarse H, Versluis E, Light DW. Policy making on data exclusivity in the European Union: from industrial interests to legal realities. J Health Politics, Policy Law 2009;34:979-1010.
11. Gagnon M-A. The $2 billion extra price tag of brand-name drugs in Canada. 2011. www.hilltimes.com/policy-briefing/2011/02/07/the-%242-billion-extra-price-tag-of-brand-namedrugs-in-canada/25433.
12. Kaitin KI, Phelan NR, Raiford D, Morris B. Therapeutic ratings and end-of-phase II conferences: initiatives to accelerate the availability of important new drugs. J Clin Pharmacol 1991;31:17-24.
13. Barral PE. 20 years of pharmaceutical research results throughout the world: 1975-94. Rhone-Poulenc Rorer Foundation, 1996.
14. Angell M. The truth about the drug companies: how they deceive us and what to do about it. Random House, 2004.
15. Hunt MI. Prescription drugs and intellectual property protection. National Institute for Health Care Management, 2000.
16. Morgan SG, Bassett KL, Wright JM, Evans R, Barer M, Caetano P, et al. “Breakthrough” drugs and growth in expenditure on prescription drugs in Canada. BMJ 2005;331:815-6.
17. Motola D, DePonti F, Poluzzi E, Martini N, Rossi P, Silvani MC, et al. An update on the first decade of the European centralized procedure: how many innovative drugs? Br J Clin Pharmacol 2006;62:610-6.
18. Prescrire Editorial Staff. A look back at 2009: one step forward, two steps back. Prescrire Int 2010;19:89-94.
19. Van Luijn J, Gribnau F, Leufkens HGM. Superior efficacy of new medicines? Eur J Clin Pharmacol 2010;66:445-8.
20. US Food and Drug Administration. Drug and biologic approval reports. 2012. www.fda.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicApprovalReports/default.htm.
21. Lexchin J. International comparison of assessments of pharmaceutical innovation. Health Policy 2012;105:221-5.
22. Light DW, ed. The risks of prescription drugs. Columbia University Press, 2010.
23. Light DW, Lexchin J. Foreign free riders and the high price of US medicines. BMJ 2005;331:958-60.
24. Light DW. Basic research funds to discover important new drugs: who contributes how much. In: Burke MA, ed. Monitoring the financial flows for health research 2005: behind the global numbers. Global Forum for Health Research, 2006:27-43.
25. Pharmaceutical Research and Manufacturers of America. 2011 profile: pharmaceutical industry. PhRMA, 2011.
26. DiMasi JA, Hansen RW, Grabowski HG. The price of innovation: new estimates of drug development costs. J Health Econ 2003;22:151-85.
27. Light DW, Warburton RN. Demythologizing the high cost of pharmaceutical research. Biosocieties 2011;6:1-17.
28. Harrison C. The patent cliff steepens. Nature Rev Drug Discov 2011;10:12-3.
29. Applbaum K. Pharmaceutical marketing and the invention of the medical consumer. PLoS Med 2006;3:e189.
30. Pfizer. Performance report—fourth quarter. Pfizer, 2012.
31. Applbaum K. Is marketing the enemy of pharmaceutical innovation? Hastings Center Report 2009;39:13-7.
32. Applbaum K. Getting to yes: corporate power and the creation of a psychopharmaceutical blockbuster. Culture Med Psychiatry 2009;33:185-215.
33. Steinman MA, Bero LA, Chen M-M, Landefeld CS. Narrative review: the promotion of gabapentin: an analysis of internal industry documents. Ann Intern Med 2006;145:284-93.
34. Kaiser Family Foundation. Profitability of pharmaceutical manufacturers, 1995-2009. 2009. http://facts.kff.org/chart.aspx?ch=218.
35. Gagnon M-A, Lexchin J. The cost of pushing pills: a new estimate of pharmaceutical promotion expenditures in the United States. PLoS Med 2008;5:e1.
36. Abraham J. Partial progress: governing the pharmaceutical industry and the NHS, 1948-2008. J Health Politics Policy Law 2009;34:931-77.
37. Regnstrom J, Koenig F, Aronsson B, Reimer T, Svendsen K, Tsigkos S, et al. Factors associated with success of market authorisation applications for pharmaceutical drugs submitted to the European Medicines Agency. Eur J lin Pharmacol 2010;66:39-48.
38. Giezen TJ, Mantel-Teeuwisse AK, Straus SMJM, Schellekens H, Leufkens HGM, Egberts ACG. Safety-related regulatory actions for biologicals approved in the United States and the European Union. JAMA 2008;300:1887-96.
39. Jøldal B. Regulation for need—the Norwegian experience. J Soc Admin Pharmacy 1984;2:81-4.
40. Dukes M, Lunde I. The regulatory control of non-steroidal anti-inflammatory agents. Eur J Clin Pharmacol 1981;19:3-10.
41. Love J. Senator Sanders introduces two medical innovation prize bills in US Senate to de-link R&D costs from drug prices. Knowledge Ecology International 27 May 2011. http: //keionline.org/node/1147.
No hay comentarios:
Publicar un comentario