jueves, 30 de agosto de 2012
la adición de clopidogrel a la aspirina no reduce elriesgo de ACV
Añadir Plavix a la aspirina no ayuda a proteger contra un segundo ACV, según un estudio
La combinación en realidad aumentó el riesgo de hemorragia y muerte en pacientes del tipo de ACV provocado por la hipertensión crónica
Por Steven Reinberg, HealthDay News 29 de agosto 2012
Añadir el trombolítico Plavix a una dosis diaria de aspirina no es mejor que tomar la aspirina sola para prevenir un segundo accidente cerebrovascular (ACV) en personas que han sufrido del tipo de ACV que por lo general es provocado por la hipertensión crónica, muestra un estudio reciente.
De hecho, la combinación aumentó el riesgo de hemorragia gastrointestinal y muerte, informan investigadores canadienses.
"La terapia antiplaquetaria es el estándar para la prevención de un segundo ACV", señaló el autor del estudio, el Dr. Robert Hart, profesor de neurología de la Universidad de McMaster en Hamilton, Ontario. "Deseábamos ver si combinar dos antiplaquetarios, aspirina y clopidogrel [Plavix], funcionaría mejor y prevendría más ACV".
"Nos decepcionó que la combinación de aspirina y clopidogrel solo mostró una tendencia no significativa en la reducción del ACV", apuntó Hart. "Por otro lado, los dos en combinación produjeron más sangrados y una mayor mortalidad. El aumento en la mortalidad fue completamente inesperado".
"Está claro que los dos fármacos no deben ser utilizados juntos de forma rutinaria en personas con ACV lacunar", añadió.
Los ACV lacunares ocurren en los vasos sanguíneos pequeños del cerebro, y lo más probable es que se deban a la hipertensión crónica. Conforman alrededor de una quinta parte de todos los ACV y son más comunes entre los negros, los hispanos y los diabéticos.
Aunque los ACV lacunares tienden a ser pequeños, pueden causar discapacidad, dependiendo del lugar del cerebro en que ocurran.
El informe aparece en la edición del 30 de agosto de la revista New England Journal of Medicine.
En el ensayo, los investigadores asignaron al azar a más de 3,000 pacientes que habían sufrido un ACV lacunar a una combinación de aspirina y Plavix, o de aspirina y un placebo.
Los pacientes también se asignaron al azar a recibir un control agresivo o estándar de la presión arterial, anotaron los investigadores.
Durante ocho años de seguimiento, la tasa de segundos ACV entre los que tomaban ambos fármacos fue de 2.5 por ciento, frente a 2.7 por ciento entre los que solo tomaban aspirina, hallaron.
La mayor parte de los segundos ACV fueron lacunares, anotaron. En total, el número de segundos ACV en ambos grupos se redujo tres veces, una reducción mayor de la esperada.
Sin embargo, la tasa de sangrado grave fue de 2.1 por ciento en el grupo de aspirina y Plavix, frente a 1.1 por ciento en el grupo de solo aspirina, señalaron los investigadores.
Además, hubo más muertes entre los que tomaban ambos fármacos. En el grupo de aspirina murieron 77 personas, frente a 113 personas muertas en el grupo de aspirina y Plavix, hallaron los investigadores. Los motivos del aumento en la tasa de muerte no se conocen, pero se están investigando, apuntó Hart.
En agosto de 2011, el ensayo se detuvo debido a los resultados. Los Institutos Nacionales de Salud (NIH) de EE. UU., que financiaron el estudio, advirtieron en ese momento que había "pocas probabilidades de un beneficio en favor de la aspirina más clopidogrel [Plavix] [para] el tratamiento del ACV recurrente si el estudio hubiera continuado hasta su conclusión".
La parte de tratamiento de la presión arterial del ensayo continúa, y se ha animado a los pacientes a seguir tomando aspirina sin Plavix, según los NIH.
Las directrices actuales recomiendan aspirina sola, Plavix solo, o aspirina más dipiridamol (Permole) para la prevención de nuevos ACV tras la mayoría de tipos de ACV, apuntó Hart.
No se sabe si una combinación de aspirina y Plavix es eficaz para prevenir otros tipos de ACV, pero se está estudiando, añadió.
"Este hallazgo fue algo sorpresivo, pero no chocante", señaló el Dr. Kirk Garratt, director de investigación cardiovascular intervencionista del Hospital Lenox Hill en la ciudad de Nueva York. "Es otro hallazgo decepcionante con los antiplaquetarios. La lección de esto es que no debemos recetar Plavix a los pacientes de ACV lacunares. Los médicos deben prestar atención a estos ensayos negativos".
http://1.usa.gov/Qfqzwr
Etiquetas:
ACV,
aspirina,
clopidogrel,
hemorragia
miércoles, 29 de agosto de 2012
Informe OBSERVAMED de Sobrecostos con Biotecnológicos en Colombia
de
Oscar Andia Salazar, MD
Director del Observatorio del Medicamento
Vicepresidente de Política Farmacéutica Nacional
Federación Médica Colombiana
Colegio Médico de Cundinamarca y Bogotá
Informe OBSERVAMED de Sobrecostos con Biotecnológicos en Colombia: ROCHE
critica y OBSERVAMED responde
Productos Roche S.A. envió una comunicación al Observatorio del Medicamento
de la Federación Médica Colombiana OBSERVAMED con duras críticas
metodológicas al Informe " "Acceso a Medicamentos Biotecnológicos: Ventas en
Colombia 2008 a 2011 y Precios comparativos con España"
OBSERVAMED contestó pidiendo a ROCHE controvertir -con datos concretos y
todos los recursos que considere pertinentes para una “comparación idónea”-
la siguiente afirmación, basada en las estimaciones empíricas de nuestro
Informe (Página 10 y Tabla N°3):
Luego de analizar ventas reportadas al SISMED de los años 2008 a 2011 y
comparar los precios reportados con precios de referencia 2011 de la Agencia
Española de Medicamentos y Productos Sanitarios AEMPS, el Observatorio del
Medicamento-FMC afirma que “3 anticuerpos monoclonales Rituximab(Mabthera),
Trastuzumab(Herceptín) y Bevacizumab(Avastin) reportaron ventas al Sismed
por COP 722.633.174.763 en los 4 años. El mayor valor pagado en Colombia por
no aplicar precios internacionales equivalentes al PVP Español se estimó en
COP 235.490.779.473.-“
Ver Carta de Roche en: http://bit.ly/PDTtUF
Ver Respuesta de OBSERVAMED en: http://bit.ly/RErYJT
Ver Informe original de OBSERVAMED en: http://bit.ly/TbaCdv
Oscar Andia Salazar, MD
Director del Observatorio del Medicamento
Vicepresidente de Política Farmacéutica Nacional
Federación Médica Colombiana
Colegio Médico de Cundinamarca y Bogotá
Informe OBSERVAMED de Sobrecostos con Biotecnológicos en Colombia: ROCHE
critica y OBSERVAMED responde
Productos Roche S.A. envió una comunicación al Observatorio del Medicamento
de la Federación Médica Colombiana OBSERVAMED con duras críticas
metodológicas al Informe " "Acceso a Medicamentos Biotecnológicos: Ventas en
Colombia 2008 a 2011 y Precios comparativos con España"
OBSERVAMED contestó pidiendo a ROCHE controvertir -con datos concretos y
todos los recursos que considere pertinentes para una “comparación idónea”-
la siguiente afirmación, basada en las estimaciones empíricas de nuestro
Informe (Página 10 y Tabla N°3):
Luego de analizar ventas reportadas al SISMED de los años 2008 a 2011 y
comparar los precios reportados con precios de referencia 2011 de la Agencia
Española de Medicamentos y Productos Sanitarios AEMPS, el Observatorio del
Medicamento-FMC afirma que “3 anticuerpos monoclonales Rituximab(Mabthera),
Trastuzumab(Herceptín) y Bevacizumab(Avastin) reportaron ventas al Sismed
por COP 722.633.174.763 en los 4 años. El mayor valor pagado en Colombia por
no aplicar precios internacionales equivalentes al PVP Español se estimó en
COP 235.490.779.473.-“
Ver Carta de Roche en: http://bit.ly/PDTtUF
Ver Respuesta de OBSERVAMED en: http://bit.ly/RErYJT
Ver Informe original de OBSERVAMED en: http://bit.ly/TbaCdv
Etiquetas:
acceso,
alto costo,
biotecnológicos,
Colombia,
OBSERVAMED,
Observatorio del Medicamento
martes, 28 de agosto de 2012
Robotril. Lo que no te da la vida te lo da la industria farmacéutica
Robotril - Peter Capusotto Y Sus Videos 27/08/2012
sin palabras
sin palabras
Etiquetas:
medicalización,
parodia,
Peter Capusotto
martes, 21 de agosto de 2012
La mayoría de las Revisiones Cochrane no informa el conflicto de intereses de los ensayos incluidos
Roseman M, Turner EH, Lexchin J, Coyne JC, Bero LA , Thombs BD. Reporting of conflicts of interest from drug trials in Cochrane reviews: cross sectional study. BMJ 2012; 345 doi: 10.1136/bmj.e5155 (Published 21 August 2012)
Objetivos: Investigar el grado en que las revisiones Cochrane de intervenciones farmacéuticas publicadas en 2010 informaron sobre los conflictos de intereses de los ensayos incluidos y, de las revisiones que informaron estos datos en que lugar de la revisión ubicaron la información.
Diseño: Estudio transversal.
Fuentes de datos: Base de Datos Cochrane de Revisiones Sistemáticas.
Criterios de selección: Revisiones sistemáticas de intervenciones farmacológicas publicados en 2010 en la Base de Datos Cochrane de Revisiones Sistemáticas, con contenido de la revisión clasificado como actualizado hasta la fecha en 2008 o más tarde y con resultados de uno o más ensayos controlados aleatorizados.
Resultados: De 151 revisiones Cochrane incluídas, 46 (30%, 95% IC, 24% a 38%) reportaron información sobre las fuentes de financiación de los ensayos incluidos, de ellos 30 (20%, IC14% y 27%) presentaron información sobre la financiación de todos los ensayos incluidos y 16 (11%, 7% y el 17%) que informaron de algunos ensayos, pero no todos. Sólo 16 de las 151 revisiones Cochrane (11%, IC 7% al 17%) proporcionó ninguna información sobre los vínculos financieros o empleo de los autores de los ensayos con la industria. La información sobre la financiación del ensayo y los vinculos del autor con la industria fue infromada en 1 a 7 posiciones diferenetes dentro de cada revisión, sin que se pudiera identificar un punto de notificación consistente.
Conclusiones: La mayortía de las revisiones Cochrane de ensayos de medicamentos publicados en 2010 no proporcionó información sobre las fuentes de financiamiento del ensayo o ni de los vínculos financieros o de empleo del autores/es con la industra financieras o de empleo.Cuando se informaron estos datos, su ubicacion de ntro de las revisiones fue irregular
disponible en texto completo en:
http://bit.ly/O0HfV0
Objetivos: Investigar el grado en que las revisiones Cochrane de intervenciones farmacéuticas publicadas en 2010 informaron sobre los conflictos de intereses de los ensayos incluidos y, de las revisiones que informaron estos datos en que lugar de la revisión ubicaron la información.
Diseño: Estudio transversal.
Fuentes de datos: Base de Datos Cochrane de Revisiones Sistemáticas.
Criterios de selección: Revisiones sistemáticas de intervenciones farmacológicas publicados en 2010 en la Base de Datos Cochrane de Revisiones Sistemáticas, con contenido de la revisión clasificado como actualizado hasta la fecha en 2008 o más tarde y con resultados de uno o más ensayos controlados aleatorizados.
Resultados: De 151 revisiones Cochrane incluídas, 46 (30%, 95% IC, 24% a 38%) reportaron información sobre las fuentes de financiación de los ensayos incluidos, de ellos 30 (20%, IC14% y 27%) presentaron información sobre la financiación de todos los ensayos incluidos y 16 (11%, 7% y el 17%) que informaron de algunos ensayos, pero no todos. Sólo 16 de las 151 revisiones Cochrane (11%, IC 7% al 17%) proporcionó ninguna información sobre los vínculos financieros o empleo de los autores de los ensayos con la industria. La información sobre la financiación del ensayo y los vinculos del autor con la industria fue infromada en 1 a 7 posiciones diferenetes dentro de cada revisión, sin que se pudiera identificar un punto de notificación consistente.
Conclusiones: La mayortía de las revisiones Cochrane de ensayos de medicamentos publicados en 2010 no proporcionó información sobre las fuentes de financiamiento del ensayo o ni de los vínculos financieros o de empleo del autores/es con la industra financieras o de empleo.Cuando se informaron estos datos, su ubicacion de ntro de las revisiones fue irregular
disponible en texto completo en:
http://bit.ly/O0HfV0
lunes, 20 de agosto de 2012
Tapentadol (Palexia®) en el dolor crónico intenso: Opioide de liberación prolongada de valor terapéutico desconocido
Juan Erviti Lopez, de la Sección de Informacion y Asesoria del Medicamento del Servicio de Prestaciones Farmaceuticas. SNS-O. Pamplona (Espanha) nos comunica que se ha publicado el último informe de evaluación de nuevos medicamentos:
“Tapentadol (Palexia®) en el dolor crónico intenso".
Opioide de liberación prolongada de valor terapéutico desconocido
- El tapentadol ha mostrado ser más eficaz que placebo en artrosis, lumbalgia y dolor neuropático diabético. No obstante, los resultados deben interpretarse con cautela dadas sus importantes limitaciones.
- No se han realizado comparaciones directas con otros opiodes. Sólo hay un análisis, en el que el tapentadol no ha mostrado diferencias con la oxicodona.
Disponible en el siguiente enlace:
http://bit.ly/NCUSib
Etiquetas:
BIT Navarra,
dolor,
opioide,
tapentadol
viernes, 17 de agosto de 2012
Investigación y desarrollo de medicamentos: ¿qué obtenemos a cambio de todo ese dinero?
La semana pasada se publico en el BMJ un excelente artículo de Donald Ligth y Joel Lexchin sobre los costos de la investigación y desarrollo.
pues bien, el Blog de Javier Padilla "médico crítico" [ " Para abrir los ojos ante la (compleja) realidad sanitaria (y socioeconómica) de nuestro entorno cercano (y no tanto)"] publica la traducción del atriculo para ponerlo a disposición del público no anglo-parlante
millón de gracias por tan valioso aporte!!!
hemos retocado un poco la traducción y agregamos los gráficos
El mito de la “crisis de innovación”
La publicación constante de informes y artículos sobre la denominada "crisis de innovación" se basa en la disminución de nuevas entidades moleculares (definidas como “un ingrediente activo que no se ha comercializado previamente… bajo ninguna formulación farmacéutica” 5) desde un pico máximo en 1996, fruto de la autorización de solicitudes acumuladas luego de que se iniciara un nuevo plan de tarifas por la revisión de las solicitudes de comercialización (Fig 1).
Fig 1. La crisis de innovación que comenzó en 1997 supone una vuelta a la antigua media de nuevas aprobaciones después de un pico artificial producido por factores politicos
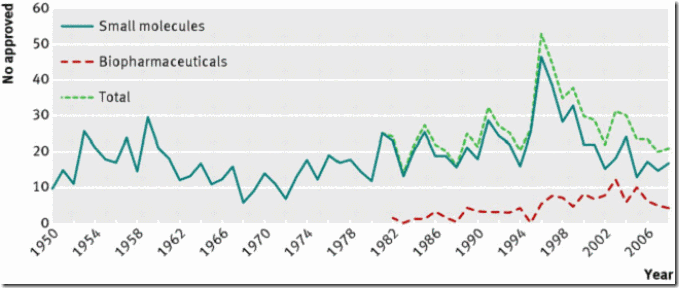
Este descenso terminó en 2006, cuando la aprobación de nuevas entidades moleculares volvió a su antiguo promedio de entre 15 y 25 por año (Fig 2)6. Incluso en 2005, un análisis de los datos por un equipo de Pfizer concluyó que la crisis de innovación era un mito “que no guarda relación con las verdaderas tasas de innovación de la industria farmacéutica” 7.
Fig 2. La tasa de aprobación de nuevas entidades moleculares volvió a su antigua media en el 2006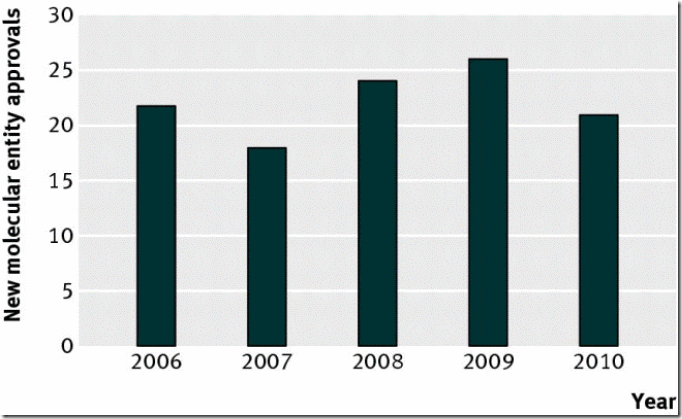
Entonces, ¿por qué no cesan estas afirmaciones e historias?
Un análisis posterior también concluyó que la crisis de innovación era un mito y a la vez añadía akgunas reflexiones al respecto. A partir de los registros de la FDA, Bernard Munos, un consultor de renombre vinculado a la innovación tecnológica, describió que las compañías farmacéuticas “han lanzado productos innovadores a un ritmo constante durante casi 60 años”. Los nuevos productos biológicos han seguido un patrón similar “en el cual las aprobaciones fluctúan en torno un nivel bajo y constante”8.
Estos datos no se corresponden con las quejas frecuentes acerca de las dificultades para obtener la aprobación de un nuevo medicamento. Asimismo opina que ni las políticas consideradas como obstáculos a la innovación (como el requerimiento de estudios clínicos más exhaustivos) ni aquellas que promocionan la innovación (como revisiones aceleradas) han supuesto una gran diferencia en la geeneración de innovación. Incluso la revolución biotecnológica no cambió el ritmo de aprobación de nuevas entidades moleculares, aunque cambió las estrategias para el desarrollo de fármacos” 9.
Mientras tanto, la estrategia de contar historias de “crisis de innovación” a los políticos y a la prensa sirve para atraer una mayor protección gubernamental contra el mercado libre y la competencia de los productos genéricos10-11.
La verdadera crisis de innovación
Más relevante que el número absoluto de nuevos medicamentos comercializados es el número de mediacamentos que representan un avance terapéutico. Aunque la industria farmacéutica y sus analistas miden la innovación en términos de nuevas entidades moleculares en lugar de nuevos medicamentos terapéuticamente superiores, la mayoría de estas nuevas entidades solo ha proporcionado mínimas ventajas clínicas en comparación con otros tratamientos existentes.
El predominio de los fármacos sin ventajas terapéuticas significativas nos retrotrae a a la “era dorada” de la innovación. De 218 fármacos aprobados por la FDA entre 1978 y 1989, solo 34 (15,6%) se consideraron como avances terapéuticos importantes 12.
Durante un periodo de tiempo bastante similar (1974-1994), el informe Barral de la industria sobre todos los nuevos fármacos comercializados internacionalmente, concluyó que solo el 11% de los fármacos supusieron una innovación terapéutica y farmacológica13.
Desde mediados de los 90, revisiones independientes también arribaron a la conclusión de que aproximadamente el 85-90% de todos los nuevos medicamentos aportaron poco o ningún beneficio terapéutico para los pacientes 14-19.
Este aumento leve y constante de medicamentos superiores clínicamente contrasta con el estado de revisión “prioritario”, concedido por la FDA al 44% de todos los nuevos fármacos desde 2000 a 2010 20. El porcentaje de medicamentos con la designación de prioritarios comenzó a aumentar en 1992 cuando las compañías comenzaron a financiar el proceso de aprobación de los fármacos de la FDA . Otras agencias reguladoras han clasifacado a pocos de esos medicamentos como candidatos para una revisión prioritaria 21. Las evaluaciones post-comercialización durante el mismo periodo son mucho menos generosas a la hora de asignar avances terapéuticos significativas a los nuevos fármacos 18-21.
Esta es la verdadera crisis de innovación: la I+D farmacéutica produce en la mayoría de los casos variaciones menores de fármacos ya existentes, y la mayoría de los nuevos fármacos no tienen impacto superior a medicamentos más antiguos en las mediciones clínicas.
Aunque un flujo constante de nuevos medicamentos con valor terapéutico añadido ha contribuido a aumentar el arsenal terapéutico del que se benefician millones de personas, los medicamentos también han producido una epidemia de reacciones adversas graves que deben añadirse a los costos nacionales de salud 22.
¿Cuánto cuesta el I+D?
Aunque la industria farmacéutica reslata constantemente las elevadas sumas de dinero que destina al descubrimiento de nuevos medicamentos, muy poco de ese dinero va a parar realmente a la investigación básica.
Los datos provenientes de informes de las propias compañías, de la Fundación Nacional de Ciencias de los Estados Unidos, y del gobierno indican que las compañías solo gastan el 1,3% de los ingresos en investigación básica para el descubrimiento de nuevas moléculas, una vez se descuentan los subsidios procedentes de los contribuyentes 23.
Más del 80 % del total de fondos destinados a la investigación básica para el descubrimiento de nuevos medicamentos y vacunas proceden de fuentes públicas 24.
Además, a pesar de las frecuentes reivindicaciones de la industria de que el costo del descubrimiento de nuevos fármacos suponen ahora un gasto de US$1.300 millones 25 esta cifra, procedente de la industria según el Centro Tufts en Boston 26, ha recibido muchas críticas.
La mitad del total procede de la estimación de los beneficios obtenidos si se invirtiera el dinero en un fondo indexado de compañías farmacéuticas con un aumento del valor del 11% anual acumulado, durante 15 años 26.
Aunque los comités financieros lo utilicen para estimar si merece la pena invertir en una nueva operación, estos supuestos beneficios (bastante mayores que el aumento del valor de las acciones de la industria farmacéutica) no deberían contabilizarse como costos en I+D en los que los beneficios están por llegar.
Los contribuyentes pagan la mitad de los US$ 650 millones restantes a través de deducciones y créditos a las compañías, lo que reduce la estimación a una cuarta parte de los US$ 1.300 millones o US$ 330 millones de dólares 27. Los autores del estudio del centro Tufts indican que su estimación se realizó sobre la quinta parte de los fármacos nuevos más costosos (aquellos desarrollados por la industria), los cuales, según los autores, fueron 3,44 veces más costosos que la media, lo cual redujo la estimación a US$90 millones. La mediana de los costos fue un tercio inferior a la media, es decir, US$60 millones. La deconstrucción de otros factores que aumentan esta cifra disminuiría aún más la estimación de los costos.
Modelo de negocio oculto
¿Cómo hemos llegado a una situación en la que parece que se gasta mucho dinero en I+D, aunque solo 1 de cada 10 medicamentos aprobados recientemente aporta un beneficio sustancial a los pacientes? La baja exigencia de ser mejor que el placebo, utilizando criterios de valoración secundarios en lugar de resultados clínicos claros, o criterios de no inferioridad con respecto al comparador, permite la aprobación de medicamentos que incluso pueden ser menos efectivos o menos seguros que los fármacos existentes. Ejemplos notables son rofecoxib (Vioxx), rosiglitazona (Avandia), gatifloxacino (Tequin), y drotrecogina alfa (Xigris).
Aunque la vasta red de departamentos de relaciones públicas y asociaciones comerciales de la industria generan un gran volumen de historias sobre la renombrada crisis de innovación, el papel clave de los fármacos superventas, y la crisis creada por “el abismo de la patente” 28 el modelo de negocio oculto de las farmacéuticas se centra en producir variaciones menores, algunas de las cuales se convierten en superventas.
En una serie de artículos escritos por Kalman Applbaum se describe cómo las compañías usan “la gestión de los ensayos clínicos, la publicación de investigaciones, el cabildeo a los reguladores, la formación a médicos y pacientes, el precio de los fármacos, la publicidad, y la promoción dirigida al consumidor” para crear distintos perfiles de márketing y la lealtad a la marca comercial para productos terapéuticamente similares 29.
Las ventas de estos fármacos generan beneficios constantes durante la vida comercial de los superventas hasta la finalización de la patente. Por ejemplo, aunque Pfizer perdió la exclusividad de mercado para atorvastatina, venlafaxina, y otros superventas en 2011, sus ingresos permanecieron constantes en comparación con 2010 y el ingreso neto aumentó un 21% 30.
Applbaum argumenta que el márketing se ha convertido en “el enemigo de la [auténtica] innovación” 31. Esta perspectiva explica por qué las compañías piensan que resulta útil pagar no solo por el estudio de los nuevos fármacos sino también por los cientos de ensayos de fármacos ya existentes con el fin de obtener la aprobación para nuevas indicaciones y expandir así el mercado 32.
Esta estrategia corporativa funciona porque los departamentos de márketing y las grandes redes de clínicos líderes de opinión patrocinados por la industria logran persuadir a los médicos para que prescriban los nuevos productos 33.
Un análisis de los gastos farmacéuticos en Canadá halló que el 80% del incremento de su
presupuesto destinado a fármacos se gasta en nuevos medicamentos que ofrecen muy pocos beneficios adicionales 16.
Entre los mayores contribuidores a este aumento se incluyen nuevos fármacos antihipertensivos, gastrointestinales y anticolesterolemiantes, incluyendo atorvastatina, la quinta estatina en el mercado canadiense.
El mito de un I+D insostenible
Para complementar la sucesión de artículos sobre la crisis de innovación nos encontramos con los artículos que tratan los costos de I+D como “insostenibles” para el reducido número de nuevos medicamentos aprobados. Estas afirmaciones sirven para justificar un mayor respaldo y protección gubernamental contra la competición de los genéricos, fortaleciendo medidas como una mayor exclusividad de datos y más subsidios públicos. Sin embargo, aunque los costos de I+D notificados aumentaron sustancialmente entre 1995 y 2010 en US$ 34.200 millones, los ingresos procedentes de los entes públicos aumentaron seis veces más rápido, en US$ 200.400 millones 25. Las compañías exageran los costos del desarrollo al centrar su discurso en el aumento autodeclarado de los costes y no mencionar los extraordinarios ingresos procedentes de los contribuyentes. Invariablemente, los beneficios netos, tras impuestos, siguen siendo sustancialmente superiores que los beneficios del resto de compañías pertenecientes a la lista del Fortune 500 34.
Este modelo de negocio oculto para la investigación, las ventas y los beneficios de las compañías farmacéuticas lleva tiempo dependiendo menos de la investigación revolucionaria que tanto enfatizan los ejecutivos, y más en las acciones de actores racionales que explotan patentes más amplias y duraderas y otras protecciones gubernamentales contra la competencia habitual del libre mercado. Las compañías están encantadas cuando se descubren fármacos revolucionarios, pero no dependen de estos, a pesar de que declaren lo contrario. Si comparamos el 1,3% de los ingresos dedicados al descubrimiento de nuevas moléculas 23 con el 25%, según estimaciones de un análisis independiente, de gasto en promoción 35, obtenemos un índice de investigación básica versus márketing de 1:19.
Hacia medicamentos más costo-efectivos y más seguros
¿Qué podemos hacer para cambiar el modelo de negocio de la industria farmacéutica y centrarnos en medicamentos más costo-efectivos y más seguros?
El primer paso debería ser detener la aprobación de tantos fármacos nuevos con escaso valor terapéutico.
La Agencia Europea del Medicamento (EMA) hace a Europa un flaco servicio al aprobar el 74% de todas las nuevas solicitudes a partir de ensayos diseñados por las compañías, mientras que mantienen en secreto los datos sobre la eficacia y la seguridad 36-37. El 29% de los nuevos productos biológicos aprobados por la EMA recibieron advertencias de seguridad en sus primeros diez años de comercialización 38, y los fármacos terapéuticamente similares por definición no ofrecen ventajas que compensen el riesgo desconocido de producir un daño mayor.
Necesitamos reactivar la cláusula noruega “necesidad médica” que limitaba la aprobación de nuevos fármacos a aquellos que ofrecían una ventaja terapéutica sobre productos existentes 39.
Este enfoque llevó a Noruega a tener siete anti-inflamatorios no esteroideos en el mercado en comparación con los 22 de Países Bajos 40.
La cláusula noruega “necesidad médica” se eliminó en 1996, cuando se armonizó su proceso de aprobación de fármacos con respecto al resto de la UE. Los países de la UE pagan miles de millones más de lo necesario por fármacos que proporcionan un beneficio sanitario escaso porque los precios no están establecidos para recompensar los nuevos fármacos en proporción al valor clínico que añaden.
Asimismo la financiación de la EMA y de otras agencias reguladoras debería proceder por entero de fondos públicos, en lugar de basarse en las cuotas que paga la industria, para terminar con el poder que la industria tiene sobre su regulador. Finalmente, consideramos nuevas formas de recompensar directamente a la innovación, como los grandes premios en metálico previstos en el Proyecto de Ley 137 del Senado, en lugar de precios elevados generados por la protección de la patente 41.
El proyecto de ley propone la recaudación de varios miles de millones de dólares anuales procedentes de 11 programas federales y no federales de reembolso y seguro sanitario, y un comité concedería los premios en función de cómo los nuevos fármacos responden a necesidades clínicas no cubiertas y si constituyen una ventaja terapéutica verdadera. Sin estar protegidos por patentes, los nuevos fármacos estarían abiertos inmediatamente a la competición de los genéricos, por lo que se reducirían los precios, mientras que al mismo tiempo los innovadores serían recompensados rápidamente para que sigan innovando. Con este enfoque los países ahorrarían miles de millones en el gasto en medicamentos y la salud de las personas se vería beneficiada.
Light DW, Lexchin JR. Pharmaceutical research and development: what do we get for all that money? BMJ. 2012 Aug 7;345:e4348. doi: 10.1136/bmj.e4348. http://bit.ly/NbZjk7
millón de gracias por tan valioso aporte!!!
hemos retocado un poco la traducción y agregamos los gráficos
Investigación y desarrollo de medicamentos: ¿qué obtenemos a cambio de todo ese dinero?
Donald W Light1, Joel R Lexchin2
Desde principios de la década de los 2000, los representantes de la industria farmacéutica, estudiosos y políticos han venido afirmando que existe una crisis de la innovación en la investigación farmacéutica. Una investigación publicada en primera página por el Wall Street Journal en el año 2002 comentaba “a lo largo del mundo, los científicos a la caza de nuevos medicamentos tienenuna escasez de ideas … la industria farmacéutica de los 400 mil millones de dólares anuales está, repentinamente, en serios problemas”1.
Cuatro años más tarde, la Oficina de Contabilidad del Gobierno de los EEUU realizó una evaluación del desarrollo de nuevos medicamentos, afirmando que “en los últimos años se ha reconocido ampliamente dentro del sector de la industria farmacéutica que la productividad de su inversión en investigación y desarrollo ha disminuido”2.
En 2010, Morgan Stanley informaba de que los altos ejecutivos de la industria sentían que no podían “derrotar la crisis de la innovación” y proponía que la mejor forma de lidiar con “una década de deprimentes retornos en I+D” era, para las grandes compañías, dejar de investigar nuevos medicamentos y comprar aquellos descubiertos por otros3. Dichos informes perpetúan e incrementan la idea de que la aparición de nuevos medicamentos pronto se agotará y quedaremos a merced de los males que nos sobrevengan4.
El mito de la “crisis de innovación”
La publicación constante de informes y artículos sobre la denominada "crisis de innovación" se basa en la disminución de nuevas entidades moleculares (definidas como “un ingrediente activo que no se ha comercializado previamente… bajo ninguna formulación farmacéutica” 5) desde un pico máximo en 1996, fruto de la autorización de solicitudes acumuladas luego de que se iniciara un nuevo plan de tarifas por la revisión de las solicitudes de comercialización (Fig 1).
Fig 1. La crisis de innovación que comenzó en 1997 supone una vuelta a la antigua media de nuevas aprobaciones después de un pico artificial producido por factores politicos

Este descenso terminó en 2006, cuando la aprobación de nuevas entidades moleculares volvió a su antiguo promedio de entre 15 y 25 por año (Fig 2)6. Incluso en 2005, un análisis de los datos por un equipo de Pfizer concluyó que la crisis de innovación era un mito “que no guarda relación con las verdaderas tasas de innovación de la industria farmacéutica” 7.
Fig 2. La tasa de aprobación de nuevas entidades moleculares volvió a su antigua media en el 2006

Entonces, ¿por qué no cesan estas afirmaciones e historias?
Un análisis posterior también concluyó que la crisis de innovación era un mito y a la vez añadía akgunas reflexiones al respecto. A partir de los registros de la FDA, Bernard Munos, un consultor de renombre vinculado a la innovación tecnológica, describió que las compañías farmacéuticas “han lanzado productos innovadores a un ritmo constante durante casi 60 años”. Los nuevos productos biológicos han seguido un patrón similar “en el cual las aprobaciones fluctúan en torno un nivel bajo y constante”8.
Estos datos no se corresponden con las quejas frecuentes acerca de las dificultades para obtener la aprobación de un nuevo medicamento. Asimismo opina que ni las políticas consideradas como obstáculos a la innovación (como el requerimiento de estudios clínicos más exhaustivos) ni aquellas que promocionan la innovación (como revisiones aceleradas) han supuesto una gran diferencia en la geeneración de innovación. Incluso la revolución biotecnológica no cambió el ritmo de aprobación de nuevas entidades moleculares, aunque cambió las estrategias para el desarrollo de fármacos” 9.
Mientras tanto, la estrategia de contar historias de “crisis de innovación” a los políticos y a la prensa sirve para atraer una mayor protección gubernamental contra el mercado libre y la competencia de los productos genéricos10-11.
La verdadera crisis de innovación
Más relevante que el número absoluto de nuevos medicamentos comercializados es el número de mediacamentos que representan un avance terapéutico. Aunque la industria farmacéutica y sus analistas miden la innovación en términos de nuevas entidades moleculares en lugar de nuevos medicamentos terapéuticamente superiores, la mayoría de estas nuevas entidades solo ha proporcionado mínimas ventajas clínicas en comparación con otros tratamientos existentes.
El predominio de los fármacos sin ventajas terapéuticas significativas nos retrotrae a a la “era dorada” de la innovación. De 218 fármacos aprobados por la FDA entre 1978 y 1989, solo 34 (15,6%) se consideraron como avances terapéuticos importantes 12.
Durante un periodo de tiempo bastante similar (1974-1994), el informe Barral de la industria sobre todos los nuevos fármacos comercializados internacionalmente, concluyó que solo el 11% de los fármacos supusieron una innovación terapéutica y farmacológica13.
Desde mediados de los 90, revisiones independientes también arribaron a la conclusión de que aproximadamente el 85-90% de todos los nuevos medicamentos aportaron poco o ningún beneficio terapéutico para los pacientes 14-19.
Este aumento leve y constante de medicamentos superiores clínicamente contrasta con el estado de revisión “prioritario”, concedido por la FDA al 44% de todos los nuevos fármacos desde 2000 a 2010 20. El porcentaje de medicamentos con la designación de prioritarios comenzó a aumentar en 1992 cuando las compañías comenzaron a financiar el proceso de aprobación de los fármacos de la FDA . Otras agencias reguladoras han clasifacado a pocos de esos medicamentos como candidatos para una revisión prioritaria 21. Las evaluaciones post-comercialización durante el mismo periodo son mucho menos generosas a la hora de asignar avances terapéuticos significativas a los nuevos fármacos 18-21.
Esta es la verdadera crisis de innovación: la I+D farmacéutica produce en la mayoría de los casos variaciones menores de fármacos ya existentes, y la mayoría de los nuevos fármacos no tienen impacto superior a medicamentos más antiguos en las mediciones clínicas.
Aunque un flujo constante de nuevos medicamentos con valor terapéutico añadido ha contribuido a aumentar el arsenal terapéutico del que se benefician millones de personas, los medicamentos también han producido una epidemia de reacciones adversas graves que deben añadirse a los costos nacionales de salud 22.
¿Cuánto cuesta el I+D?
Aunque la industria farmacéutica reslata constantemente las elevadas sumas de dinero que destina al descubrimiento de nuevos medicamentos, muy poco de ese dinero va a parar realmente a la investigación básica.
Los datos provenientes de informes de las propias compañías, de la Fundación Nacional de Ciencias de los Estados Unidos, y del gobierno indican que las compañías solo gastan el 1,3% de los ingresos en investigación básica para el descubrimiento de nuevas moléculas, una vez se descuentan los subsidios procedentes de los contribuyentes 23.
Más del 80 % del total de fondos destinados a la investigación básica para el descubrimiento de nuevos medicamentos y vacunas proceden de fuentes públicas 24.
Además, a pesar de las frecuentes reivindicaciones de la industria de que el costo del descubrimiento de nuevos fármacos suponen ahora un gasto de US$1.300 millones 25 esta cifra, procedente de la industria según el Centro Tufts en Boston 26, ha recibido muchas críticas.
La mitad del total procede de la estimación de los beneficios obtenidos si se invirtiera el dinero en un fondo indexado de compañías farmacéuticas con un aumento del valor del 11% anual acumulado, durante 15 años 26.
Aunque los comités financieros lo utilicen para estimar si merece la pena invertir en una nueva operación, estos supuestos beneficios (bastante mayores que el aumento del valor de las acciones de la industria farmacéutica) no deberían contabilizarse como costos en I+D en los que los beneficios están por llegar.
Los contribuyentes pagan la mitad de los US$ 650 millones restantes a través de deducciones y créditos a las compañías, lo que reduce la estimación a una cuarta parte de los US$ 1.300 millones o US$ 330 millones de dólares 27. Los autores del estudio del centro Tufts indican que su estimación se realizó sobre la quinta parte de los fármacos nuevos más costosos (aquellos desarrollados por la industria), los cuales, según los autores, fueron 3,44 veces más costosos que la media, lo cual redujo la estimación a US$90 millones. La mediana de los costos fue un tercio inferior a la media, es decir, US$60 millones. La deconstrucción de otros factores que aumentan esta cifra disminuiría aún más la estimación de los costos.
Modelo de negocio oculto
¿Cómo hemos llegado a una situación en la que parece que se gasta mucho dinero en I+D, aunque solo 1 de cada 10 medicamentos aprobados recientemente aporta un beneficio sustancial a los pacientes? La baja exigencia de ser mejor que el placebo, utilizando criterios de valoración secundarios en lugar de resultados clínicos claros, o criterios de no inferioridad con respecto al comparador, permite la aprobación de medicamentos que incluso pueden ser menos efectivos o menos seguros que los fármacos existentes. Ejemplos notables son rofecoxib (Vioxx), rosiglitazona (Avandia), gatifloxacino (Tequin), y drotrecogina alfa (Xigris).
Aunque la vasta red de departamentos de relaciones públicas y asociaciones comerciales de la industria generan un gran volumen de historias sobre la renombrada crisis de innovación, el papel clave de los fármacos superventas, y la crisis creada por “el abismo de la patente” 28 el modelo de negocio oculto de las farmacéuticas se centra en producir variaciones menores, algunas de las cuales se convierten en superventas.
En una serie de artículos escritos por Kalman Applbaum se describe cómo las compañías usan “la gestión de los ensayos clínicos, la publicación de investigaciones, el cabildeo a los reguladores, la formación a médicos y pacientes, el precio de los fármacos, la publicidad, y la promoción dirigida al consumidor” para crear distintos perfiles de márketing y la lealtad a la marca comercial para productos terapéuticamente similares 29.
Las ventas de estos fármacos generan beneficios constantes durante la vida comercial de los superventas hasta la finalización de la patente. Por ejemplo, aunque Pfizer perdió la exclusividad de mercado para atorvastatina, venlafaxina, y otros superventas en 2011, sus ingresos permanecieron constantes en comparación con 2010 y el ingreso neto aumentó un 21% 30.
Applbaum argumenta que el márketing se ha convertido en “el enemigo de la [auténtica] innovación” 31. Esta perspectiva explica por qué las compañías piensan que resulta útil pagar no solo por el estudio de los nuevos fármacos sino también por los cientos de ensayos de fármacos ya existentes con el fin de obtener la aprobación para nuevas indicaciones y expandir así el mercado 32.
Esta estrategia corporativa funciona porque los departamentos de márketing y las grandes redes de clínicos líderes de opinión patrocinados por la industria logran persuadir a los médicos para que prescriban los nuevos productos 33.
Un análisis de los gastos farmacéuticos en Canadá halló que el 80% del incremento de su
presupuesto destinado a fármacos se gasta en nuevos medicamentos que ofrecen muy pocos beneficios adicionales 16.
Entre los mayores contribuidores a este aumento se incluyen nuevos fármacos antihipertensivos, gastrointestinales y anticolesterolemiantes, incluyendo atorvastatina, la quinta estatina en el mercado canadiense.
El mito de un I+D insostenible
Para complementar la sucesión de artículos sobre la crisis de innovación nos encontramos con los artículos que tratan los costos de I+D como “insostenibles” para el reducido número de nuevos medicamentos aprobados. Estas afirmaciones sirven para justificar un mayor respaldo y protección gubernamental contra la competición de los genéricos, fortaleciendo medidas como una mayor exclusividad de datos y más subsidios públicos. Sin embargo, aunque los costos de I+D notificados aumentaron sustancialmente entre 1995 y 2010 en US$ 34.200 millones, los ingresos procedentes de los entes públicos aumentaron seis veces más rápido, en US$ 200.400 millones 25. Las compañías exageran los costos del desarrollo al centrar su discurso en el aumento autodeclarado de los costes y no mencionar los extraordinarios ingresos procedentes de los contribuyentes. Invariablemente, los beneficios netos, tras impuestos, siguen siendo sustancialmente superiores que los beneficios del resto de compañías pertenecientes a la lista del Fortune 500 34.
Este modelo de negocio oculto para la investigación, las ventas y los beneficios de las compañías farmacéuticas lleva tiempo dependiendo menos de la investigación revolucionaria que tanto enfatizan los ejecutivos, y más en las acciones de actores racionales que explotan patentes más amplias y duraderas y otras protecciones gubernamentales contra la competencia habitual del libre mercado. Las compañías están encantadas cuando se descubren fármacos revolucionarios, pero no dependen de estos, a pesar de que declaren lo contrario. Si comparamos el 1,3% de los ingresos dedicados al descubrimiento de nuevas moléculas 23 con el 25%, según estimaciones de un análisis independiente, de gasto en promoción 35, obtenemos un índice de investigación básica versus márketing de 1:19.
Hacia medicamentos más costo-efectivos y más seguros
¿Qué podemos hacer para cambiar el modelo de negocio de la industria farmacéutica y centrarnos en medicamentos más costo-efectivos y más seguros?
El primer paso debería ser detener la aprobación de tantos fármacos nuevos con escaso valor terapéutico.
La Agencia Europea del Medicamento (EMA) hace a Europa un flaco servicio al aprobar el 74% de todas las nuevas solicitudes a partir de ensayos diseñados por las compañías, mientras que mantienen en secreto los datos sobre la eficacia y la seguridad 36-37. El 29% de los nuevos productos biológicos aprobados por la EMA recibieron advertencias de seguridad en sus primeros diez años de comercialización 38, y los fármacos terapéuticamente similares por definición no ofrecen ventajas que compensen el riesgo desconocido de producir un daño mayor.
Necesitamos reactivar la cláusula noruega “necesidad médica” que limitaba la aprobación de nuevos fármacos a aquellos que ofrecían una ventaja terapéutica sobre productos existentes 39.
Este enfoque llevó a Noruega a tener siete anti-inflamatorios no esteroideos en el mercado en comparación con los 22 de Países Bajos 40.
La cláusula noruega “necesidad médica” se eliminó en 1996, cuando se armonizó su proceso de aprobación de fármacos con respecto al resto de la UE. Los países de la UE pagan miles de millones más de lo necesario por fármacos que proporcionan un beneficio sanitario escaso porque los precios no están establecidos para recompensar los nuevos fármacos en proporción al valor clínico que añaden.
Asimismo la financiación de la EMA y de otras agencias reguladoras debería proceder por entero de fondos públicos, en lugar de basarse en las cuotas que paga la industria, para terminar con el poder que la industria tiene sobre su regulador. Finalmente, consideramos nuevas formas de recompensar directamente a la innovación, como los grandes premios en metálico previstos en el Proyecto de Ley 137 del Senado, en lugar de precios elevados generados por la protección de la patente 41.
El proyecto de ley propone la recaudación de varios miles de millones de dólares anuales procedentes de 11 programas federales y no federales de reembolso y seguro sanitario, y un comité concedería los premios en función de cómo los nuevos fármacos responden a necesidades clínicas no cubiertas y si constituyen una ventaja terapéutica verdadera. Sin estar protegidos por patentes, los nuevos fármacos estarían abiertos inmediatamente a la competición de los genéricos, por lo que se reducirían los precios, mientras que al mismo tiempo los innovadores serían recompensados rápidamente para que sigan innovando. Con este enfoque los países ahorrarían miles de millones en el gasto en medicamentos y la salud de las personas se vería beneficiada.
La verdadera crisis en la investigación farmacéutica
El número de licencias de nuevos fármacos permanece en la antigua media de 15-25 anuales.
Sin embargo, el 85-90% de los nuevos productos en los últimos 50 años han proporcionado pocos beneficios y considerables daños.
La industria farmacéutica dedica la mayoría de los fondos para la investigación al desarrollo de nuevas variaciones menores que producen un flujo estable de beneficios.
Las fuertes promociones de estos fármacos contribuyen al sobreuso y suponen el 80% del incremento del gasto farmacéutico de una nación. Unas estimaciones infladas de los costos medios del I+D se emplean para cabildear y obtener mayor protección contra la competencia del mercado libre.
|
Autores
DWL concibió, investigó, y escribió el manuscrito inicial. JRL investigó y efectuó la revisión, realizando cambios sustanciales.
Referencias
1. Harris G. For drug makers, good times yield to a new profit crunch. Wall Street Journal 2002 Apr 18.
2. United States Government Accounting Office. New drug development. GAO, 2006.
3. Morgan Stanley. Pharmaceuticals: exit research and create value. Morgan Stanley, 2010.
4. Wilson D. Drug firms face billions in losses in ’11 as patents end. New York Times 2011 Mar 6. www.nytimes.com/2011/03/07/business/07drug.html?_r=1&pagewanted=all.
5. US Food and Drug Administration. Drugs@FDA glossary of terms. 2012. http://www.fda.gov/ Drugs/InformationOnDrugs/ucm079436.htm?utm_campaign=Google2&utm_source=fdaSearch&utm_medium=website&utm_term=“glossary%20of%20terms”&utm_content=2.
6. US Food and Drug Administration. New molecular entity approvals for 2010. Silver Spring: FDA, 2011. www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicApprovalReports/UCM242695.pdf.
7. Schmid E, Smith D. Is declining innovation in the pharmaceutical industry a myth? Drug Discov Today 2005;10:1031-9.
8. Munos B. Lessons from 60 years of pharmaceutical innovation. Nature Rev Drug Discov 2009;8:959-68.
9. Hopkins MM, Martin PA, Nightingale P, Kraft A, Mahdi S. The myth of the biotech revolution: an assessment of technological, clinical, and organizational change. Res Policy2007;36:566-89.
10. Adamini S, Maarse H, Versluis E, Light DW. Policy making on data exclusivity in the European Union: from industrial interests to legal realities. J Health Politics, Policy Law 2009;34:979-1010.
11. Gagnon M-A. The $2 billion extra price tag of brand-name drugs in Canada. 2011. www.hilltimes.com/policy-briefing/2011/02/07/the-%242-billion-extra-price-tag-of-brand-namedrugs-in-canada/25433.
12. Kaitin KI, Phelan NR, Raiford D, Morris B. Therapeutic ratings and end-of-phase II conferences: initiatives to accelerate the availability of important new drugs. J Clin Pharmacol 1991;31:17-24.
13. Barral PE. 20 years of pharmaceutical research results throughout the world: 1975-94. Rhone-Poulenc Rorer Foundation, 1996.
14. Angell M. The truth about the drug companies: how they deceive us and what to do about it. Random House, 2004.
15. Hunt MI. Prescription drugs and intellectual property protection. National Institute for Health Care Management, 2000.
16. Morgan SG, Bassett KL, Wright JM, Evans R, Barer M, Caetano P, et al. “Breakthrough” drugs and growth in expenditure on prescription drugs in Canada. BMJ 2005;331:815-6.
17. Motola D, DePonti F, Poluzzi E, Martini N, Rossi P, Silvani MC, et al. An update on the first decade of the European centralized procedure: how many innovative drugs? Br J Clin Pharmacol 2006;62:610-6.
18. Prescrire Editorial Staff. A look back at 2009: one step forward, two steps back. Prescrire Int 2010;19:89-94.
19. Van Luijn J, Gribnau F, Leufkens HGM. Superior efficacy of new medicines? Eur J Clin Pharmacol 2010;66:445-8.
20. US Food and Drug Administration. Drug and biologic approval reports. 2012. www.fda.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicApprovalReports/default.htm.
21. Lexchin J. International comparison of assessments of pharmaceutical innovation. Health Policy 2012;105:221-5.
22. Light DW, ed. The risks of prescription drugs. Columbia University Press, 2010.
23. Light DW, Lexchin J. Foreign free riders and the high price of US medicines. BMJ 2005;331:958-60.
24. Light DW. Basic research funds to discover important new drugs: who contributes how much. In: Burke MA, ed. Monitoring the financial flows for health research 2005: behind the global numbers. Global Forum for Health Research, 2006:27-43.
25. Pharmaceutical Research and Manufacturers of America. 2011 profile: pharmaceutical industry. PhRMA, 2011.
26. DiMasi JA, Hansen RW, Grabowski HG. The price of innovation: new estimates of drug development costs. J Health Econ 2003;22:151-85.
27. Light DW, Warburton RN. Demythologizing the high cost of pharmaceutical research. Biosocieties 2011;6:1-17.
28. Harrison C. The patent cliff steepens. Nature Rev Drug Discov 2011;10:12-3.
29. Applbaum K. Pharmaceutical marketing and the invention of the medical consumer. PLoS Med 2006;3:e189.
30. Pfizer. Performance report—fourth quarter. Pfizer, 2012.
31. Applbaum K. Is marketing the enemy of pharmaceutical innovation? Hastings Center Report 2009;39:13-7.
32. Applbaum K. Getting to yes: corporate power and the creation of a psychopharmaceutical blockbuster. Culture Med Psychiatry 2009;33:185-215.
33. Steinman MA, Bero LA, Chen M-M, Landefeld CS. Narrative review: the promotion of gabapentin: an analysis of internal industry documents. Ann Intern Med 2006;145:284-93.
34. Kaiser Family Foundation. Profitability of pharmaceutical manufacturers, 1995-2009. 2009. http://facts.kff.org/chart.aspx?ch=218.
35. Gagnon M-A, Lexchin J. The cost of pushing pills: a new estimate of pharmaceutical promotion expenditures in the United States. PLoS Med 2008;5:e1.
36. Abraham J. Partial progress: governing the pharmaceutical industry and the NHS, 1948-2008. J Health Politics Policy Law 2009;34:931-77.
37. Regnstrom J, Koenig F, Aronsson B, Reimer T, Svendsen K, Tsigkos S, et al. Factors associated with success of market authorisation applications for pharmaceutical drugs submitted to the European Medicines Agency. Eur J lin Pharmacol 2010;66:39-48.
38. Giezen TJ, Mantel-Teeuwisse AK, Straus SMJM, Schellekens H, Leufkens HGM, Egberts ACG. Safety-related regulatory actions for biologicals approved in the United States and the European Union. JAMA 2008;300:1887-96.
39. Jøldal B. Regulation for need—the Norwegian experience. J Soc Admin Pharmacy 1984;2:81-4.
40. Dukes M, Lunde I. The regulatory control of non-steroidal anti-inflammatory agents. Eur J Clin Pharmacol 1981;19:3-10.
41. Love J. Senator Sanders introduces two medical innovation prize bills in US Senate to de-link R&D costs from drug prices. Knowledge Ecology International 27 May 2011. http: //keionline.org/node/1147.
jueves, 16 de agosto de 2012
FDA riesgo con el uso de codeina postoperatoria en niños metabolizadores ultrarapidos
El uso de codeína en ciertos niños después de la amigdalectomía y / o adenoidectomía: Riesgo raro, pero potencialmente mortal de eventos adversos o muerte
FDA MEDWatch, 15 de agosto 2012
La FDA está revisando los informes de niños que desarrollaron efectos adversos graves o murieron después de tomar codeína para el alivio del dolor después de la amigdalectomía y / o adenoidectomía para el síndrome de apnea obstructiva del sueño. Recientemente se han documentado en la literatura médica, tres muertes de niños y un caso no mortal, pero que puso en peligro la vida por depresión respiratoria, que aparecieron en artículos publicados en New England Journal of Medicine en el 2009 y la revista Pediatrics en el 2012.
Estos niños (edades de dos a cinco) tenían evidencia de un trastorno hereditario (genético) de la capacidad para convertir codeína en cantidades de morfina que ponen en riesgo la vida o producen la muerte.
el tratorno es relativamente raro, aparece entre una a siete de cada 100 personas. Pero la frecuencia podría ser de hasta 28 de cada 100 personas en ciertos grupos, como los africanos del norte, los etíopes y los saudíes.
Todos los niños habían recibido dosis de codeína que se encontraban dentro del rango de dosis habituales.
Antecedentes: Cuando se ingiere la codeína, esta se convierte en morfina en el hígado por una enzima llamada citocromo P450 2D6 (CYP2D6). Algunas personas tienen variaciones en el ADN que hacen que esta enzima trabaje de manera más activa, haciendo que la codeína se convierta en morfina más rápida y más completa que en otras personas. Estos "metabolizadores ultrarápidos " son más propensos a tener cantidades de morfina en la sangre más altas de lo normal después de tomar la codeína. Los altos niveles de morfina pueden dar como resultado dificultad para respirar, que puede ser fatal. Tomar codeína después de una amigdalectomía y / o adenoidectomía pueden aumentar el riesgo de problemas respiratorios y la muerte en los niños que son "metabolizadores ultrarápidos ".
RECOMENDACIÓN: Los profesionales sanitarios deben ser conscientes de los riesgos del uso de codeína en niños, particularmente en aquellos que han sido sometidos a amigdalectomía y / o adenoidectomía para el síndrome de apnea obstructiva del sueño. Si la prescripción medicamentos que contienen codeína, se debe utilizar la dosis mínima efectiva durante el menor período de tiempo en una función de las necesidades (es decir, no programado durante todo el día).
Los padres y cuidadores que observen somnolencia inusual, confusión o dificultad para respirar o ruidosa en su hijo debe buscar atención médica inmediatamente, ya que estos son signos de sobredosis.
Los articulos mencionados son
Ciszkowski C, Madadi P, Phillips MS, Lauwers AE, Koren G. Codeine, ultrarapid-metabolism genotype, and postoperative death. N Engl J Med 2009;361:827-8.
http://bit.ly/P17OtO
Kelly LE, Rieder M, van den Anker J, Malkin B, Ross C, Neely MN, et al. More codeine fatalities after tonsillectomy in North American children. Pediatrics 2012;129:e1343-7.
http://bit.ly/Poi4yX
La notificación original de la FDA http://bit.ly/codeinan
FDA MEDWatch, 15 de agosto 2012
La FDA está revisando los informes de niños que desarrollaron efectos adversos graves o murieron después de tomar codeína para el alivio del dolor después de la amigdalectomía y / o adenoidectomía para el síndrome de apnea obstructiva del sueño. Recientemente se han documentado en la literatura médica, tres muertes de niños y un caso no mortal, pero que puso en peligro la vida por depresión respiratoria, que aparecieron en artículos publicados en New England Journal of Medicine en el 2009 y la revista Pediatrics en el 2012.
Estos niños (edades de dos a cinco) tenían evidencia de un trastorno hereditario (genético) de la capacidad para convertir codeína en cantidades de morfina que ponen en riesgo la vida o producen la muerte.
el tratorno es relativamente raro, aparece entre una a siete de cada 100 personas. Pero la frecuencia podría ser de hasta 28 de cada 100 personas en ciertos grupos, como los africanos del norte, los etíopes y los saudíes.
Todos los niños habían recibido dosis de codeína que se encontraban dentro del rango de dosis habituales.
Antecedentes: Cuando se ingiere la codeína, esta se convierte en morfina en el hígado por una enzima llamada citocromo P450 2D6 (CYP2D6). Algunas personas tienen variaciones en el ADN que hacen que esta enzima trabaje de manera más activa, haciendo que la codeína se convierta en morfina más rápida y más completa que en otras personas. Estos "metabolizadores ultrarápidos " son más propensos a tener cantidades de morfina en la sangre más altas de lo normal después de tomar la codeína. Los altos niveles de morfina pueden dar como resultado dificultad para respirar, que puede ser fatal. Tomar codeína después de una amigdalectomía y / o adenoidectomía pueden aumentar el riesgo de problemas respiratorios y la muerte en los niños que son "metabolizadores ultrarápidos ".
RECOMENDACIÓN: Los profesionales sanitarios deben ser conscientes de los riesgos del uso de codeína en niños, particularmente en aquellos que han sido sometidos a amigdalectomía y / o adenoidectomía para el síndrome de apnea obstructiva del sueño. Si la prescripción medicamentos que contienen codeína, se debe utilizar la dosis mínima efectiva durante el menor período de tiempo en una función de las necesidades (es decir, no programado durante todo el día).
Los padres y cuidadores que observen somnolencia inusual, confusión o dificultad para respirar o ruidosa en su hijo debe buscar atención médica inmediatamente, ya que estos son signos de sobredosis.
Los articulos mencionados son
Ciszkowski C, Madadi P, Phillips MS, Lauwers AE, Koren G. Codeine, ultrarapid-metabolism genotype, and postoperative death. N Engl J Med 2009;361:827-8.
http://bit.ly/P17OtO
Kelly LE, Rieder M, van den Anker J, Malkin B, Ross C, Neely MN, et al. More codeine fatalities after tonsillectomy in North American children. Pediatrics 2012;129:e1343-7.
http://bit.ly/Poi4yX
La notificación original de la FDA http://bit.ly/codeinan
Etiquetas:
codeína,
efectos adversos,
FDA,
metabolizadores rápidos,
morfina,
muerte
WHO Pharmaceuticals Newsletter No. 4, 2012
Contenido
Regulatory Matters
Calcitonin- containing medicines ..................................................................... 4
Candesartan ................................................................................................ 4
Dabigatran etexilate ..................................................................................... 5
Dalfampridine .............................................................................................. 5
Denosumab ................................................................................................. 5
Doripenem .................................................................................................. 6
Febuxostat .................................................................................................. 6
Tolperisone ................................................................................................. 6
Trimetazidine-containing medicines ................................................................ 7
Hepatitis B Immune Globulin (Human) Injection ............................................... 8
Immune Globulin Intravenous (Human) ........................................................... 8
Oral tacrolimus ............................................................................................ 8
Safety of medicines
Bisphosphonates, corticosteroids, angiogenesis inhibitors and
denosumab ................................................................................................ 10
Butterbur ................................................................................................... 10
Caffeine citrate ........................................................................................... 10
Non-steroidal anti-inflammatory drugs....................................................... 10
Peanut Oil .................................................................................................. 11
Serotonergic medicines ................................................................................ 11
Statins and ciclosporin ................................................................................. 12
Tacrolimus ointment .................................................................................... 12
Zolpidem ................................................................................................... 12
Signal
Dronedarone, hyperthyroidism and decreased Thyroid Stimulating
Hormone.................................................................................................... 14
Mometasone and Arrhythmia ........................................................................ 20
Feature
Paediatric morphine dosages......................................................................... 26
Ninth meeting of the WHO Advisory Committee on Safety of Medicinal
Products (ACSoMP) ...................................................................................... 29 proximamente en http://www.who.int/medicines/publications/newsletter/en/
Etiquetas:
bifosfonatos,
calcitonina,
candesartán,
dabigatrán,
dalfampridine,
Denosumab,
doripenem,
estatinas,
febuxostat,
mometasona,
OMS,
Signal,
tacrolimus,
tolperisona,
trimetazidina,
Uppsala Monitoring Centre,
zolpidem
miércoles, 15 de agosto de 2012
Los beneficios de los fármacos antihipertensivos para la hipertensión leve no están claros
esa es la conclusión de la revisión cochrane que se acaba de publicar
Diao D, Wright JM, Cundiff DK, Gueyffier F. Pharmacotherapy for mild hypertension. Cochrane Database of Systematic Reviews 2012, Issue 8. Art. No.: CD006742. DOI: 10.1002/14651858.CD006742.pub2
15 de agosto de 2012.
Los individuos con hipèrtensión leve presión arterial ligeramente elevada, pero sin eventos cardiovasculares previos, constituyen la mayoría de las personas para las cuales se considerada y se prescribe tratamiento antihipertensivo. La decisión de tratar a esta población tiene importantes consecuencias tanto para los pacientes (por ejemplo, efectos adversos del fármaco, duración del tratamiento farmacológico, costo del tratamiento, etc) y el tercer pagador (por ejemplo, costo elevado de los medicamentos, servicios médicos, pruebas de laboratorio, etc .). En esta revisión, se resumen las pruebas existentes que comparan los resultados de salud entre los individuos con hipertensió leve tratados y no tratados. Los datos disponibles a partir del número limitado de estudios y participantes disponibles, no mostraron diferencias entre los individuos tratados y no tratados, en términos de eventos isquémicos, accidentes cerebrovasculares y muerte. De los 11ensayos clínicos controlados ( ECA) identificados en esta revisión, se incluyeron cuatro, con 8,912 participantes. El tratamiento con fármacos antihipertensivos durante 4 a 5 años en comparación con el placebo, no redujo la mortalidad total (RR 0,85, IC 95%: 0,63 a 1,15). En 7.080 participantes el tratamiento con fármacos antihipertensivos en comparación con el placebo, no redujo la enfermedad coronaria (RR 1,12, IC 95% 0,80, 1,57), accidente cerebrovascular (RR 0,51, IC 95%: 0,24 a 1,08), o el total de eventos cardiovasculares (RR: 0,97; 95%: 0,72 a 1,32). El retiro del fármaco por efectos adversos fue significativamente mayor en el grupo de tratamiento (RR 4,80, IC 95% 4,14, 5,57), ARR = 9%.
Los autores concluyen que los fármacos antihipertensivos utilizados en el tratamiento de los adultos (prevención primaria) con hipertensión leve (presión arterial sistólica 140-159 mmHg y / o diastólica 90-99 mmHg ) no han demostrado reducir la mortalidad o la morbilidad en los ECA. Aproximadamente el 9% de los pacientes tratados con fármacos interrumpieron el tratamiento debido a efectos adversos.
Se necesitan más ensayos clínicos controlados en esta población prevalente para saber si los beneficios del tratamiento superan los daños.
Revisión sistemática completa disponible en: http://bit.ly/N622Wr
lunes, 13 de agosto de 2012
Hemos Leido: Medicamentos & embarazo, análisis de los sistemas de clasificación de fármacos
excelente comentario del día de hoy al respecto de los compañeros de “Hemos leído"
las palabras iniciales
Medicamentos y embarazo: Sistemas de clasificación de fármacos y algunos recursos útiles
Si hablamos de embarazo y fármacos, se nos viene a la cabeza la extendida clasificación de la FDA; clasificación americana puesta en marcha allá por los años 1979, como respuesta a la tragedia producida por el uso de la talidomida en mujeres embarazadas. Y preguntamos: ¿sabías qué…
- Otros países también han adoptado sistemas de clasificación de medicamentos para su uso en embarazadas. Los más conocidos son el sistema de clasificación Swedish Catalogue of Approved Drugs (FASS), y el Australiano (Australian Drug Evaluation Committee (ADEC)), Comité que en 2010 fue reemplazado por el Advisory Committee on Prescription Medicines (ACPM).
Según un estudio publicado en el Drug Safety del año 2000, sólo 1 de cada 4 medicamentos se clasificaba con similar categoría de riesgo de estos tres sistemas de clasificación citados. Las diferencias se atribuían a la disparidad entre las definiciones, así como en la disparidad de literatura y fuentes consultadas para determinar el riesgo de los medicamentos.
Comentamos algunos aspectos que pueden ser de interés sobre los sistemas de clasificación: http://www.hemosleido.es/2012/08/13/medicamentos-embarazo-sistemas-de-clasificacion-de-farmacos-y-algunos-recursos-utiles/
Etiquetas:
Australia,
BNF,
clasificación de riesgo,
embarazo,
FDA,
Hemos Leído,
Reino Unido,
Suecia
Precaución con el uso off label del bexaroteno , en Alzheimer
Cautela alrededor de un posible tratamiento contra el Alzheimer
- Los especialistas recuerdan lo mucho que queda por hacer en esta enfermedad
- Los efectos secundarios de este medicamento no son del todo inocuos
María Valerio, Diario el Mundo 13/08/2012
El pasado mes de febrero, un estudio preliminar realizado únicamente en ratones demostró que un fármaco ya autorizado contra ciertos tipos de cáncer podría revertir los síntomas de Alzheimer en los roedores.
Sin embargo, mientras esos mismos resultados logran replicarse en humanos, pacientes y familiares (sobre todo en EEUU) se han dejado atraer por el optimismo del titular.
Esta reacción popular ha provocado que esta semana varios especialistas en las páginas de la revista 'The New England Journal of Medicine' pidan cautela y recuerden lo mucho que aún queda por hacer.
El 'problema' radica en que el fármaco (bexaroteno) ya está autorizado oficialmente para el tratamiento de linfomas cutáneos, lo que permite que algunos neurólogos en EEUU lo receten para otra indicación diferente a través de una figura administrativa denominada 'off label' (fuera de indicación). Sin embargo, como recuerdan esta semana Frank LaFerla (de la Universidad de California, EEUU) y Justin Lowenthal, Sara Chandos y Steven Pearson (de los Institutos Nacionales de Salud, NIH), todavía quedan demasiadas dudas por resolver antes de que pueda plantearse siquiera el uso del medicamento en humanos. "No sería la primera vez que unos resultados prometedores en modelos preclínicos [con animales] fracasan en humanos", apunta LaFerla.
"Algunos pacientes me llamaron a los pocos días de aparecer la noticia", admite también el doctor Pablo Martínez-Lage, coordinador del grupo de estudios de la conducta y demencias de la Sociedad Española de Neurología, "pero obviamente, la respuesta es no". A su juicio, aunque el medicamento lleva 13 años aprobado, sus efectos secundarios no son del todo inocuos y, por tanto, "la seguridad en este escenario es desconocida".
Incluso admitiendo que los resultados son prometedores, los especialistas de los NIH insisten en que bexaroteno no debería prescribirse para el tratamiento del Alzheimer en humanos antes de que se lleve a cabo ningún ensayo clínico (lo que está previsto a corto plazo). Porque, como recuerdan a los pacientes, aunque se conocen sus riesgos derivados de su uso como fármaco oncológico, de momento es demasiado pronto siquiera para saber cuál debería ser la dosis idónea en el caso de querer usarlo también en neurología; lo que incrementa las incógnitas.
El ensayo que ha despertado todas estas reacciones de cautela en EEUU fue publicado en el mes de febrero en la revista 'Science'. Gary Landreth y sus colaboradores, de la Universidad Case Western (en Cleveland, EEUU), demostraron que este antitumoral era capaz de eliminar hasta un 75% las placas de proteína beta-amiloide causante del Alzheimer y, lo que es más importante, mejorar las capacidades cerebrales de los animales (cognición, memoria, habilidades sociales...).
A pesar del optimismo, no sería la primera vez que un tratamiento exitoso en ratones no logra reproducir sus resultados cuando se traslada a pacientes. LaFerla sospecha que estos fracasos repetidos tienen que ver con el hecho de que la mayoría de fármacos van dirigidos únicamente contra uno de los 'elementos' causantes del Alzheimer (la formación de placas tóxicas), y no contra todos ellos, como la muerte neuronal o los llamados ovillos neurofibrilares (agregaciones de otra proteína diferente a la beta-amiloide denominada Tau).
De momento, señalan, "es extremadamente prematuro creer que hemos encontrado una terapia efectiva contra el Alzheimer en humanos", rematan los especialistas de lso NIH; "aunque no es prematuro prepararse para esa posibilidad". Una idea en la que coincide el especialista español: "Desde luego los resultados por sí solos no nos permiten hablar de un uso clínico, pero sí son suficientes para iniciar un ensayo clínico que ratifique estas observaciones".
Esta misma semana, las compañías Pfizer y Johnson&Johnson han anunciado que interrumpen los dos ensayos que tenían en marcha con otro medicamento contra el Alzheimer, bapineuzumab, que no ha logrado demostrar mejoría en los grupos de pacientes en los que se estaba probando.
Bapineuzumab actúa contra la proteína beta-amiloide, una de las 'causantes' mejor conocidas del Alzheimer. Sin embargo, este enésimo fracaso comienza a hacer pensar a los científicos que por esta vía no lograrán tener éxito. De hecho, Martínez-Lage señala que el medicamento que ha tenido éxito en ratones, bexaroteno, funciona por una vía totalmente distinta: activa la producción de la proteína ApoE, que de manera innata sería la encargada de destruir las placas tóxicas de manera endógena. Es decir, estimulando un mecanismo natural podría lograrse reducir la placa de beta-amiloide con más éxito.
"Además, no hay que olvidar, que en los pacientes que ya han desarrollado demencia, esta proteína tóxica ya ha causado daños; de manera que necesitaríamos administrar los tratamientos anti beta-amiloide en una fase muy temprana de la enfermedad para lograr ser efectivos", concluye el neurólogo español.
Enlace a articulo original http://bit.ly/oncoalzhe
- Los especialistas recuerdan lo mucho que queda por hacer en esta enfermedad
- Los efectos secundarios de este medicamento no son del todo inocuos
María Valerio, Diario el Mundo 13/08/2012
El pasado mes de febrero, un estudio preliminar realizado únicamente en ratones demostró que un fármaco ya autorizado contra ciertos tipos de cáncer podría revertir los síntomas de Alzheimer en los roedores.
Sin embargo, mientras esos mismos resultados logran replicarse en humanos, pacientes y familiares (sobre todo en EEUU) se han dejado atraer por el optimismo del titular.
Esta reacción popular ha provocado que esta semana varios especialistas en las páginas de la revista 'The New England Journal of Medicine' pidan cautela y recuerden lo mucho que aún queda por hacer.
El 'problema' radica en que el fármaco (bexaroteno) ya está autorizado oficialmente para el tratamiento de linfomas cutáneos, lo que permite que algunos neurólogos en EEUU lo receten para otra indicación diferente a través de una figura administrativa denominada 'off label' (fuera de indicación). Sin embargo, como recuerdan esta semana Frank LaFerla (de la Universidad de California, EEUU) y Justin Lowenthal, Sara Chandos y Steven Pearson (de los Institutos Nacionales de Salud, NIH), todavía quedan demasiadas dudas por resolver antes de que pueda plantearse siquiera el uso del medicamento en humanos. "No sería la primera vez que unos resultados prometedores en modelos preclínicos [con animales] fracasan en humanos", apunta LaFerla.
"Algunos pacientes me llamaron a los pocos días de aparecer la noticia", admite también el doctor Pablo Martínez-Lage, coordinador del grupo de estudios de la conducta y demencias de la Sociedad Española de Neurología, "pero obviamente, la respuesta es no". A su juicio, aunque el medicamento lleva 13 años aprobado, sus efectos secundarios no son del todo inocuos y, por tanto, "la seguridad en este escenario es desconocida".
Incluso admitiendo que los resultados son prometedores, los especialistas de los NIH insisten en que bexaroteno no debería prescribirse para el tratamiento del Alzheimer en humanos antes de que se lleve a cabo ningún ensayo clínico (lo que está previsto a corto plazo). Porque, como recuerdan a los pacientes, aunque se conocen sus riesgos derivados de su uso como fármaco oncológico, de momento es demasiado pronto siquiera para saber cuál debería ser la dosis idónea en el caso de querer usarlo también en neurología; lo que incrementa las incógnitas.
El ensayo que ha despertado todas estas reacciones de cautela en EEUU fue publicado en el mes de febrero en la revista 'Science'. Gary Landreth y sus colaboradores, de la Universidad Case Western (en Cleveland, EEUU), demostraron que este antitumoral era capaz de eliminar hasta un 75% las placas de proteína beta-amiloide causante del Alzheimer y, lo que es más importante, mejorar las capacidades cerebrales de los animales (cognición, memoria, habilidades sociales...).
A pesar del optimismo, no sería la primera vez que un tratamiento exitoso en ratones no logra reproducir sus resultados cuando se traslada a pacientes. LaFerla sospecha que estos fracasos repetidos tienen que ver con el hecho de que la mayoría de fármacos van dirigidos únicamente contra uno de los 'elementos' causantes del Alzheimer (la formación de placas tóxicas), y no contra todos ellos, como la muerte neuronal o los llamados ovillos neurofibrilares (agregaciones de otra proteína diferente a la beta-amiloide denominada Tau).
De momento, señalan, "es extremadamente prematuro creer que hemos encontrado una terapia efectiva contra el Alzheimer en humanos", rematan los especialistas de lso NIH; "aunque no es prematuro prepararse para esa posibilidad". Una idea en la que coincide el especialista español: "Desde luego los resultados por sí solos no nos permiten hablar de un uso clínico, pero sí son suficientes para iniciar un ensayo clínico que ratifique estas observaciones".
Esta misma semana, las compañías Pfizer y Johnson&Johnson han anunciado que interrumpen los dos ensayos que tenían en marcha con otro medicamento contra el Alzheimer, bapineuzumab, que no ha logrado demostrar mejoría en los grupos de pacientes en los que se estaba probando.
Bapineuzumab actúa contra la proteína beta-amiloide, una de las 'causantes' mejor conocidas del Alzheimer. Sin embargo, este enésimo fracaso comienza a hacer pensar a los científicos que por esta vía no lograrán tener éxito. De hecho, Martínez-Lage señala que el medicamento que ha tenido éxito en ratones, bexaroteno, funciona por una vía totalmente distinta: activa la producción de la proteína ApoE, que de manera innata sería la encargada de destruir las placas tóxicas de manera endógena. Es decir, estimulando un mecanismo natural podría lograrse reducir la placa de beta-amiloide con más éxito.
"Además, no hay que olvidar, que en los pacientes que ya han desarrollado demencia, esta proteína tóxica ya ha causado daños; de manera que necesitaríamos administrar los tratamientos anti beta-amiloide en una fase muy temprana de la enfermedad para lograr ser efectivos", concluye el neurólogo español.
Enlace a articulo original http://bit.ly/oncoalzhe
Etiquetas:
Alzheimer,
bexaroteno,
cáncer,
investigación y desarrollo,
medios,
uso off label
Bit de Navarra: Suplementos de calcio: ¿lo estamos haciendo bien?
Nuevo número del Bit de Navarra: Suplementos de calcio: ¿lo estamos haciendo bien?
Autor:
Javier Garjón . Servicio de Prestaciones Farmacéuticas. SNS - O
Resumen
Objetivo: mostrar los datos sobre el riesgo cardiovascular del uso de suplementos de calcio y contraponerlos con los de su eficacia para la prevención de fracturas.
Métodos: se presentan los estudios y revisiones sistemáticas recientes que han evaluado el riesgo cardiovascular de los suplementos de calcio. Para contraponer los beneficios, se buscaron también revisiones sistemáticas sobre el efecto de los suplementos de calcio en la prevención de fracturas.
La búsqueda se realizó en TRIP database y PubMed, actualizada a 4 de abril de 2012.
Resultados y conclusiones:
hay datos que indican que los suplementos de calcio pudieran aumentar el riesgo cardiovascular, pero éstos son poco consistentes en lo que se refiere al uso de calcio asociado a vitamina D.
En personas menores de 70 años y con un consumo dietético adecuado, los suplementos de calcio no han demostrado eficacia en la prevención de fracturas.
La menopausia no es una indicación para el uso de calcio.
Los ancianos frágiles son los que se pueden beneficiar.
Los datos de factura de cadera y de riesgo cardiovascular apoyan el uso asociado a vitamina
el BIT: Volumen 20, Número 3. Mayo - Junio 2012
disponible en: http://bit.ly/QufLa7
Autor:
Javier Garjón . Servicio de Prestaciones Farmacéuticas. SNS - O
Resumen
Objetivo: mostrar los datos sobre el riesgo cardiovascular del uso de suplementos de calcio y contraponerlos con los de su eficacia para la prevención de fracturas.
Métodos: se presentan los estudios y revisiones sistemáticas recientes que han evaluado el riesgo cardiovascular de los suplementos de calcio. Para contraponer los beneficios, se buscaron también revisiones sistemáticas sobre el efecto de los suplementos de calcio en la prevención de fracturas.
La búsqueda se realizó en TRIP database y PubMed, actualizada a 4 de abril de 2012.
Resultados y conclusiones:
hay datos que indican que los suplementos de calcio pudieran aumentar el riesgo cardiovascular, pero éstos son poco consistentes en lo que se refiere al uso de calcio asociado a vitamina D.
En personas menores de 70 años y con un consumo dietético adecuado, los suplementos de calcio no han demostrado eficacia en la prevención de fracturas.
La menopausia no es una indicación para el uso de calcio.
Los ancianos frágiles son los que se pueden beneficiar.
Los datos de factura de cadera y de riesgo cardiovascular apoyan el uso asociado a vitamina
el BIT: Volumen 20, Número 3. Mayo - Junio 2012
disponible en: http://bit.ly/QufLa7
viernes, 10 de agosto de 2012
Un fallo judicial permite a los médicos alemanes aceptar dinero de las compañías farmacéuticas
Un fallo judicial permite a los médicos alemanes aceptar dinero de las compañías farmacéuticas
Una nota del Lancet comenta un reciente fallo de la Suprema Corte de Alemania ha causado un gran revuelo sobre la conducta ética de los médicos y las compañías farmacéuticas en ese país.Los médicos sin relación de dependencia en Alemania que acepten hasta € 10 000 de las compañías farmacéuticas en efectivo o regalos tales como computadoras, equipos, o vacaciones, no se enfrentarán a cargos de corrupción.
El Tribunal Federal de Justicia, en Karlsruhe, Alemania Tribunal Supremo, dictaminó que las compañías farmacéuticas no pueden ser penalizadas por la legislación vigente, aun cuando paguen a los médicos alemanes independientes para que receten sus medicamentos.
Del mismo modo los médicos pueden ahora oficialmente aceptar este dinero sin que ninguna de las partes deba enfrentar cargos criminales de soborno.
La sentencia podría aplicarse a alrededor de 124.000 de 342.000 médicos que trabajan en ese país, que incluye alrededor de 121 700 médicos independientes que trabajan con contratos temporales en el sistema nacional de salud de Alemania.
El caso más reciente en cuestión se refería a un representante de ventas de una empresa de la farmacéutica alemana que, a través de su programa de beneficios, pagó en efectivo a un grupo de médicos del Servicio Nacional de Salud. Cada médico recibió una comisión del 5% por cada producto que prescribía.
Aunque la empresa oficialmente dijo que el dinero era una remuneración por presentaciones académicas, nunca se llevaron a cabo estos seminarios. El agente de las ventas entonces fue acusado del soborno comercial por un tribunal inferior, y multado.
Cuando el representante de ventas apeló, el caso fue remitido al Tribunal Federal de Justicia. Aquí, el Gran Panel Penal (Grand Criminal Panel) revocó la decisión del tribunal inferior, y absolvió a los acusados. A continuación, también declaró que los médicos no eran ni funcionarios, ni representantes de una institución estatal, por lo que no podría ser acusados en la figura de "corrupción de funcionarios públicos", tal como se define en el párrafo 332 del Código Penal alemán, o en el derecho penal. El tribunal sostuvó además que los médicos tampoco eran empleados ni representantes de una operación de negocios, por lo que no podría ser acusado de soborno comercial en virtud del párrafo 299.
La decisión del tribunal ha sido bien recibida por una amplia gama de las principales organizaciones sanitarias alemanas. Aunque sin hacer declaraciones directas, en un comunicado de prensa Birgit Fischer, director gerente de la Asociación de compañías farmacéuticas basadas en Investigación, dijo que la decisión significaba que los médicos "... ahora pueden continuar como miembros de una profesión libre y no ser catatalogados simplemente como la extensión del brazo de los fondos del seguro de salud ".
En declaraciones al Lancet, el director de la Asociación Médica Alemana, Frank Ulrich Montgomery, compartió el punto de vista, diciendo que la decisión judicial protege los derechos de los médicos que operan en calidad de profesional independiente. "Los médicos de este tipo no son funcionarios públicos o empleados de ninguna persona, por lo que deben ser libres para realizar el trabajo independiente para sus clientes, de la misma manera que puede hacerlo un arquitecto o un abogado puede".
"Los trabajadores autónomos no dependen de los fondos de seguros de salud y esto es bueno. Si fueran funcionarios públicos, o hubieran sido comisionado por el fondo de salud, entonces estaría trabajando para el fondo de salud y por lo tanto si estaría subordinado a él. Esto significa que tendrían que tener en cuenta el interés económico de este fondo de seguro antes de que las necesidades del paciente. Un profesional independiente está libre de esta agenda económica ".
Gran parte de la prensa alemana, sin embargo, ha informado de esta reciente sentencia judicial en términos de que ahora oficialmente se dio el derecho legal a las empresas farmacéuticas y los médicos para sobornar y ser sobornados, respectivamente.
La cobertura ha incluido títulos como "El soborno de los médicos es completamente legal" de la cadena de noticias channel n-tv.
Según Montgomery, la cobertura mediática del caso es parte de una amplia campaña para empañar la reputación de los médicos.
"Ahora tenemos una campaña orquestada por los fondos de seguro de salud para sugerir que los médicos son totalmente corruptos ... El Tribunal Supremo ha descartado que el médico haya violado la ley penal, pero definitivamente esto no brinda ahora el derecho a los médicos a ser sobornado por la industria farmacéutica. Hacer esto viola el código profesional de la Asociación Médica Alemana ".
Para Ann Marini, vocera de la Asociación Central de los Fondos de Seguro de Salud, no es suficiente para un código de conducta profesional que se dejen de aplicar sanciones que el sistema jurídico no es capaz de hacer. Dijo que el Tribunal Supremo no ha tomado una postura clara sobre el verdadero problema. "No puede ser que el comportamiento de un tipo de médicos es considerado por el Código Penal alemán un delito de soborno, y sin embargo, el mismo comportamiento de un médico independiente es perfectamente legal. Nos habría gustado que el tribunal abiertamente y claramente hubiera dicho que todos los médicos, de todo tipo, pueden ser procesado por corrupción ".
la nota
Hyde R. German doctors free to take cash from drug firms. The Lancet, Volume 380, Issue 9841, Page 551, 11 August 2012 doi:10.1016/S0140-6736(12)61314-2 disponible en: http://bit.ly/P57j4g
Etiquetas:
Alemania,
corrupción,
industria farmacéutica,
sobornos
jueves, 9 de agosto de 2012
Los pacientes no saben que usan sus medicamentos " off label "
Con frecuencia, los pacientes ignoran que usan fármacos 'fuera de etiqueta', según un estudio
Es común que los médicos receten medicamentos en formas no aprobadas por la FDA, señalan investigadores
HealthDay News 8 de agosto
Muchos pacientes que son tratados con fármacos "fuera de etiqueta" no saben que los medicamentos que les recetó el médico no se están usando de formas que cuenten con la aprobación de la Administración de Drogas y Alimentos (FDA) de EE. UU., muestra una investigación.
El uso de medicamentos fuera de etiqueta es un término que se usa para describir su uso en una dosis, en una forma de dosificación o para un propósito que no ha sido aprobado por la FDA, explicaron los investigadores en el informe que aparece en la edición en línea del 6 de agosto de la revista Mayo Clinic Proceedings.
"Dado que la FDA no regula la práctica de la medicina, el uso fuera de etiqueta se ha convertido en algo muy común", señaló en un comunicado de prensa de la Clínica Mayo el autor líder del estudio, el Dr. Christopher Wittich, médico interno de la clínica en Rochester, Minnesota. "Los proveedores de atención y los pacientes deben educarse sobre los fármacos fuera de etiqueta para sopesar los riesgos y los beneficios antes de que el médico los recete o el paciente los tome".
Un informe de 2006 reveló que entre los medicamentos más comunes, alrededor de una de cada cinco recetas era para un uso fuera de etiqueta, apuntaron los investigadores. Por ejemplo, algunos antidepresivos se consideran como tratamiento primario para el dolor neuropático, aunque ese uso no haya sido aprobado por la FDA.
La morfina, al igual que muchos broncodilatadores inhalados, antimicrobianos, anticonvulsivos e inhibidores de la bomba de protones, también se recetan a niños sin la aprobación de la FDA para su uso pediátrico. Investigaciones anteriores han mostrado que alrededor del 79 por ciento de los niños tomaban al menos un fármaco fuera de etiqueta cuando fueron dados de alta de un hospital pediátrico, anotaron los autores del estudio en el comunicado de prensa.
Dado que los médicos no tienen la obligación de revelar el uso fuera de etiqueta de un fármaco y este uso tampoco conlleva una responsabilidad legal para ellos, a los pacientes por lo general no se les informa que están tomando un medicamento de una forma que no ha sido aprobada por la FDA, apuntaron los investigadores.
Sin embargo, a las farmacéuticas no se les permite promover los usos fuera de etiqueta de sus medicamentos. Hacerlo puede resultar en multas sustanciales, explicaron los autores del estudio. Por ejemplo, hace poco GlaxoSmithKline aceptó pagar la histórica cifra de tres mil millones de dólares para resolver un caso sobre un supuesto mercadeo para el uso fuera de etiqueta de un fármaco, y Merck Sharp & Dohme recibió una multa de 322 millones de dólares por supuestamente promover el analgésico Vioxx para un uso fuera de etiqueta.
Pero, anotaron Wittich y colegas, las compañías farmacéuticas sí pueden responder a preguntas de los proveedores de atención de salud y distribuir publicaciones revisadas por profesionales sobre el uso de fármacos fuera de etiqueta.
El alto costo y el largo proceso para obtener la aprobación de la FDA podría evitar que las farmacéuticas busquen la aprobación para una nueva indicación de un fármaco, sugirieron los investigadores.
El articulo original
Wittich CM, Burkle CM, Lanier WL. Ten Common Questions (and Their Answers) About Off-label Drug Use. Mayo Clin Proc. 2012 Aug 2.
Disponible en http://bit.ly/OV0NuP
Es común que los médicos receten medicamentos en formas no aprobadas por la FDA, señalan investigadores
HealthDay News 8 de agosto
Muchos pacientes que son tratados con fármacos "fuera de etiqueta" no saben que los medicamentos que les recetó el médico no se están usando de formas que cuenten con la aprobación de la Administración de Drogas y Alimentos (FDA) de EE. UU., muestra una investigación.
El uso de medicamentos fuera de etiqueta es un término que se usa para describir su uso en una dosis, en una forma de dosificación o para un propósito que no ha sido aprobado por la FDA, explicaron los investigadores en el informe que aparece en la edición en línea del 6 de agosto de la revista Mayo Clinic Proceedings.
"Dado que la FDA no regula la práctica de la medicina, el uso fuera de etiqueta se ha convertido en algo muy común", señaló en un comunicado de prensa de la Clínica Mayo el autor líder del estudio, el Dr. Christopher Wittich, médico interno de la clínica en Rochester, Minnesota. "Los proveedores de atención y los pacientes deben educarse sobre los fármacos fuera de etiqueta para sopesar los riesgos y los beneficios antes de que el médico los recete o el paciente los tome".
Un informe de 2006 reveló que entre los medicamentos más comunes, alrededor de una de cada cinco recetas era para un uso fuera de etiqueta, apuntaron los investigadores. Por ejemplo, algunos antidepresivos se consideran como tratamiento primario para el dolor neuropático, aunque ese uso no haya sido aprobado por la FDA.
La morfina, al igual que muchos broncodilatadores inhalados, antimicrobianos, anticonvulsivos e inhibidores de la bomba de protones, también se recetan a niños sin la aprobación de la FDA para su uso pediátrico. Investigaciones anteriores han mostrado que alrededor del 79 por ciento de los niños tomaban al menos un fármaco fuera de etiqueta cuando fueron dados de alta de un hospital pediátrico, anotaron los autores del estudio en el comunicado de prensa.
Dado que los médicos no tienen la obligación de revelar el uso fuera de etiqueta de un fármaco y este uso tampoco conlleva una responsabilidad legal para ellos, a los pacientes por lo general no se les informa que están tomando un medicamento de una forma que no ha sido aprobada por la FDA, apuntaron los investigadores.
Sin embargo, a las farmacéuticas no se les permite promover los usos fuera de etiqueta de sus medicamentos. Hacerlo puede resultar en multas sustanciales, explicaron los autores del estudio. Por ejemplo, hace poco GlaxoSmithKline aceptó pagar la histórica cifra de tres mil millones de dólares para resolver un caso sobre un supuesto mercadeo para el uso fuera de etiqueta de un fármaco, y Merck Sharp & Dohme recibió una multa de 322 millones de dólares por supuestamente promover el analgésico Vioxx para un uso fuera de etiqueta.
Pero, anotaron Wittich y colegas, las compañías farmacéuticas sí pueden responder a preguntas de los proveedores de atención de salud y distribuir publicaciones revisadas por profesionales sobre el uso de fármacos fuera de etiqueta.
El alto costo y el largo proceso para obtener la aprobación de la FDA podría evitar que las farmacéuticas busquen la aprobación para una nueva indicación de un fármaco, sugirieron los investigadores.
El articulo original
Wittich CM, Burkle CM, Lanier WL. Ten Common Questions (and Their Answers) About Off-label Drug Use. Mayo Clin Proc. 2012 Aug 2.
Disponible en http://bit.ly/OV0NuP
Etiquetas:
EE.UU.,
FDA,
industria farmacéutica,
investigación y desarrollo,
uso off label
miércoles, 8 de agosto de 2012
Pfizer paga multa por sobornos fuera de EEUU
Pfizer acuerda pagar 60 millones de dólares por casos de sobornos
La farmacéutica sobornó a médicos y funcionarios públicos en el extranjero
Con esto, el Departamento de Justicia de EEUU declina el proceso criminal
EFE 07/08/2012
La farmacéutica Pfizer acordó hoy con el Departamento de Justicia de Estados Unidos pagar varias multas por valor de más de 60 millones de dólares (más de 48 millones de euros) por sobornar a médicos, reguladores y funcionarios públicos en el extranjero.
El Departamento de Justicia ha anunciado que Pfizer ha acordado poner fin a las disputas sobre sus prácticas ilegales con el pago de una multa de 15 millones de dólares, así como el reembolso de 26,3 millones de dólares en beneficios al regulador del mercado de valores, la SEC.
Otra subsidiaria, adquirida por la farmacéutica estadounidense en 2009, Wyeth, pagará 18,8 millones en reembolso de beneficios y gastos del proceso legal para resolver el contencioso con las autoridades estadounidenses.
Los sobornos se produjeron en Rusia, Bulgaria, Croacia, Kazajistán, Serbia, República Checa, China e Italia.
Este acuerdo en el pago de multas hacen que el Departamento de Justicia decline perseguir un proceso criminal contra la farmacéutica por pagos impropios para conseguir una mejor posición de mercado para sus productos.
En 2004, Pfizer fue la primera gran farmacéutica que decidió cooperar con el Departamento de Justicia en la investigación de conductas ilegales en el extranjero de empresas que cotizan en bolsa, punibles en Estados Unidos.
Johnson & Johnson ya acordó el pasado año pagar 70 millones de dólares por sobornos en países como Grecia, Polonia o Irak.
http://bit.ly/sobornoPfz
Etiquetas:
coimas,
EE.UU.,
industria farmacéutica,
Pfizer,
sobornos